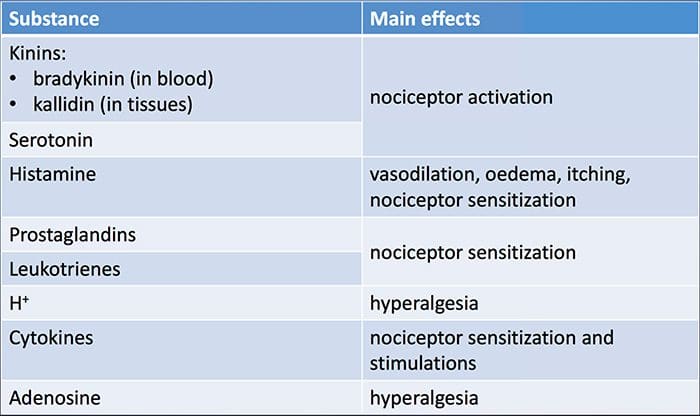
Bioquímica da dor:�Todas as síndromes de dor teñen un perfil de inflamación. Un perfil inflamatorio pode variar dunha persoa a outra e tamén pode variar nunha persoa en diferentes momentos. O tratamento das síndromes de dor é comprender este perfil de inflamación. As síndromes de dor trátanse médicamente, cirurxicamente ou ambos. O obxectivo é inhibir/suprimir a produción de mediadores inflamatorios. E un resultado exitoso é aquel que produce menos inflamación e, por suposto, menos dor.
Contidos
Bioquímica da dor
Obxectivos:
- Quen son os xogadores clave
- Cales son os mecanismos bioquímicos?
- Cales son as consecuencias?
Revisión da inflamación:
Xogadores clave
 Por que me doe o ombreiro? Unha revisión da base neuroanatómica e bioquímica da dor no ombreiro
Por que me doe o ombreiro? Unha revisión da base neuroanatómica e bioquímica da dor no ombreiro
RESUMO
Se un paciente pregunta "por que me doe o ombreiro?", a conversación converterase rapidamente en teoría científica e ás veces conxecturas sen fundamento. Con frecuencia, o médico toma conciencia dos límites da base científica da súa explicación, demostrando a incompletitude da nosa comprensión da natureza da dor no ombreiro. Esta revisión adopta un enfoque sistemático para axudar a responder preguntas fundamentais relacionadas coa dor no ombreiro, co fin de proporcionar información sobre investigacións futuras e novos métodos para tratar a dor no ombreiro. Exploraremos os papeis de (1) os receptores periféricos, (2) o procesamento da dor periférica ou "nocicepción", (3) a medula espiñal, (4) o cerebro, (5) a localización dos receptores no ombreiro e (6) ) a anatomía neural do ombreiro. Tamén consideramos como estes factores poden contribuír á variabilidade na presentación clínica, ao diagnóstico e ao tratamento da dor no ombreiro. Deste xeito, pretendemos ofrecer unha visión xeral das partes compoñentes do sistema periférico de detección da dor e dos mecanismos centrais de procesamento da dor na dor de ombreiro que interactúan para producir dor clínica.
INTRODUCIÓN: UNHA HISTORIA MÁIS BRIEF DA CIENCIA DOLOR ESENCIAL PARA CLINICOS
A natureza da dor, en xeral, foi un tema de moita controversia durante o século pasado. No século XVII, a teoría de Descartes17 propoñía que a intensidade da dor estaba directamente relacionada coa cantidade de lesión tisular asociada e que a dor se procesaba nunha vía distinta. Moitas teorías anteriores baseáronse nesta chamada filosofía descartiana "dualista", que consideraba a dor como a consecuencia da estimulación dun receptor de dor periférico "específico" no cerebro. No século XX produciuse unha batalla científica entre dúas teorías opostas, a teoría da especificidade e a teoría de patróns. A "teoría da especificidade" descartiana consideraba a dor como unha modalidade separada específica de entrada sensorial co seu propio aparello, mentres que a "teoría do patrón" consideraba que a dor era o resultado da intensa estimulación de receptores inespecíficos.1 En 20, Wall e Melzack 2. A teoría da porta da dor proporcionou probas para un modelo no que a percepción da dor foi modulada tanto pola retroalimentación sensorial como polo sistema nervioso central. Outro gran avance na teoría da dor ao mesmo tempo viu o descubrimento do modo específico de acción dos opioides.1965 Posteriormente, os avances recentes en neuroimaxes e medicina molecular ampliaron moito a nosa comprensión global da dor.
Entón, como se relaciona isto coa dor no ombreiro?A dor no ombreiro é un problema clínico común, e unha comprensión sólida da forma en que o corpo procesa a dor é esencial para diagnosticar e tratar mellor a dor dun paciente. Os avances no noso coñecemento do procesamento da dor prometen explicar o desaxuste entre a patoloxía e a percepción da dor, tamén poden axudarnos a explicar por que certos pacientes non responden a certos tratamentos.
BLOQUES CONSTRUCTIVOS BÁSICOS DO DOLOR
Receptores sensoriais periféricos: o mecanorreceptor e o �nociceptor�
Existen numerosos tipos de receptores sensoriais periféricos presentes no sistema músculo-esquelético humano. 5 Pódense clasificar en función da súa función (como mecanorreceptores, termorreceptores ou nociceptores) ou da súa morfoloxía (terminacións nerviosas libres ou diferentes tipos de receptores encapsulados). a presenza de determinados marcadores químicos. Existen solapamentos significativos entre as diferentes clases funcionais de receptores, por exemplo
Procesamento da dor periférica: �Nocicepción�
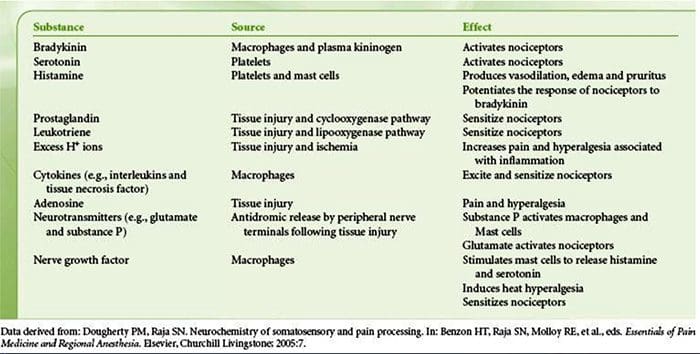
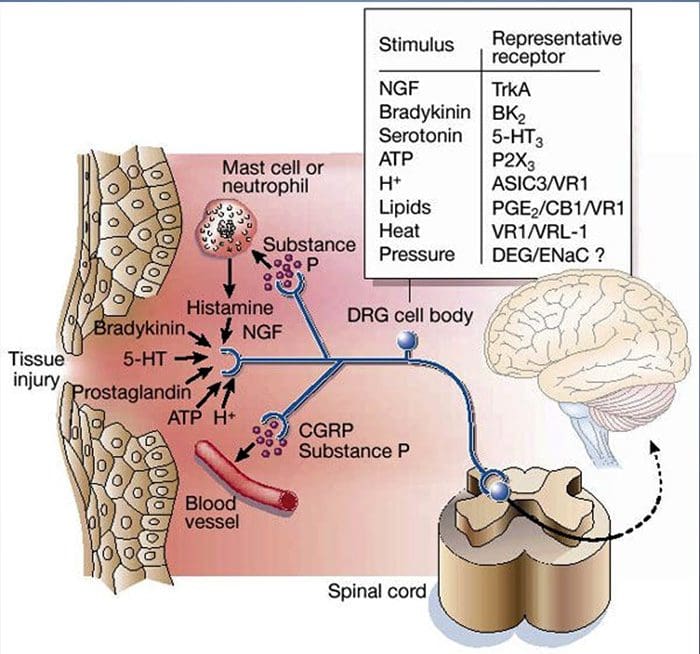
A lesión do tecido implica que as células danadas liberan unha variedade de mediadores inflamatorios, incluíndo bradicinina, histamina, 5-hidroxitriptamina, ATP, óxido nítrico e certos ións (K+ e H+). A activación da vía do ácido araquidónico leva á produción de prostaglandinas, tromboxanos e leucotrienos. Tamén se liberan citocinas, incluíndo as interleucinas e o factor de necrose tumoral ?, e as neurotrofinas, como o factor de crecemento nervioso (NGF), que están íntimamente implicadas na facilitación da inflamación.15 Outras substancias como os aminoácidos excitadores (glutamato) e os opioides ( endotelina-1) tamén estiveron implicados na resposta inflamatoria aguda.16 17 Algúns destes axentes poden activar directamente os nociceptores, mentres que outros provocan o recrutamento doutras células que despois liberan outros axentes facilitadores.18 Este proceso local ten como resultado un aumento da capacidade de resposta. de neuronas nociceptivas á súa entrada normal e/ou o recrutamento dunha resposta a entradas normalmente sublimiares denomínase "sensibilización periférica". A figura 1 resume algúns dos mecanismos clave implicados.
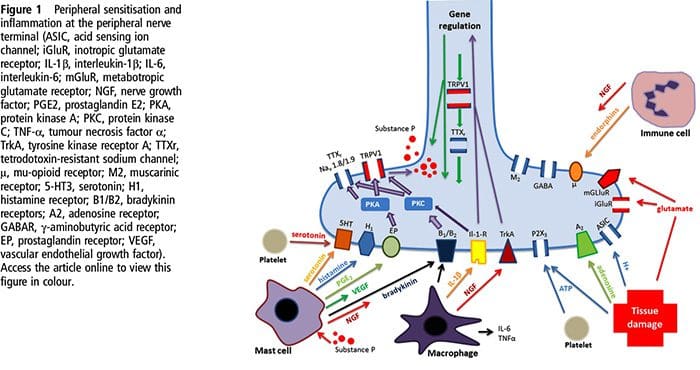 O NGF e o receptor da subfamilia V membro 1 da canle catiónica potencial do receptor transitorio (TRPV1) teñen unha relación simbiótica cando se trata de inflamación e sensibilización dos nociceptores. As citocinas producidas no tecido inflamado producen un aumento da produción de NGF.19 O NGF estimula a liberación de histamina e serotonina (5-HT3) polos mastocitos, e tamén sensibiliza aos nociceptores, alterando posiblemente as propiedades de A? fibras de tal xeito que unha maior proporción se volven nociceptivas. O receptor TRPV1 está presente nunha subpoboación de fibras aferentes primarias e é activado pola capsaicina, a calor e os protóns. O receptor TRPV1 sintetízase no corpo celular da fibra aferente, e transpórtase tanto aos terminais periféricos como aos centrais, onde contribúe á sensibilidade das aferentes nociceptivas. A inflamación dá lugar á produción periférica de NGF, que se une ao receptor tipo 1 do receptor da tirosina quinase nos terminais do nociceptor, o NGF transpórtase despois ao corpo celular onde leva a unha regulación á alza da transcrición de TRPV1 e, en consecuencia, a unha maior sensibilidade dos nociceptores.19 20 NGF e outros mediadores inflamatorios tamén sensibilizan TRPV1 a través dunha variedade diversa de vías de mensaxería secundaria. Tamén se cre que moitos outros receptores, incluídos os receptores colinérxicos, os receptores de ácido β-aminobutírico (GABA) e os receptores de somatostatina, están implicados na sensibilidade dos nociceptores periféricos.
O NGF e o receptor da subfamilia V membro 1 da canle catiónica potencial do receptor transitorio (TRPV1) teñen unha relación simbiótica cando se trata de inflamación e sensibilización dos nociceptores. As citocinas producidas no tecido inflamado producen un aumento da produción de NGF.19 O NGF estimula a liberación de histamina e serotonina (5-HT3) polos mastocitos, e tamén sensibiliza aos nociceptores, alterando posiblemente as propiedades de A? fibras de tal xeito que unha maior proporción se volven nociceptivas. O receptor TRPV1 está presente nunha subpoboación de fibras aferentes primarias e é activado pola capsaicina, a calor e os protóns. O receptor TRPV1 sintetízase no corpo celular da fibra aferente, e transpórtase tanto aos terminais periféricos como aos centrais, onde contribúe á sensibilidade das aferentes nociceptivas. A inflamación dá lugar á produción periférica de NGF, que se une ao receptor tipo 1 do receptor da tirosina quinase nos terminais do nociceptor, o NGF transpórtase despois ao corpo celular onde leva a unha regulación á alza da transcrición de TRPV1 e, en consecuencia, a unha maior sensibilidade dos nociceptores.19 20 NGF e outros mediadores inflamatorios tamén sensibilizan TRPV1 a través dunha variedade diversa de vías de mensaxería secundaria. Tamén se cre que moitos outros receptores, incluídos os receptores colinérxicos, os receptores de ácido β-aminobutírico (GABA) e os receptores de somatostatina, están implicados na sensibilidade dos nociceptores periféricos.
Un gran número de mediadores inflamatorios estiveron implicados especificamente na dor de ombreiro e na enfermidade do manguito rotador.21�25 Aínda que algúns mediadores químicos activan directamente os nociceptores, a maioría provocan cambios na propia neurona sensorial en lugar de activala directamente. Estes cambios poden ser dependentes da transcrición post-tradución precoz ou atrasada. Exemplos dos primeiros son os cambios no receptor TRPV1 ou nas canles iónicas activadas por voltaxe resultantes da fosforilación de proteínas unidas á membrana. Exemplos destes últimos inclúen o aumento inducido por NGF na produción da canle TRV1 e a activación inducida polo calcio de factores de transcrición intracelulares.
Mecanismos moleculares da nocicepción
A sensación de dor advírtanos dunha lesión real ou inminente e desencadea respostas protectoras adecuadas. Desafortunadamente, a dor adoita sobrevivir á súa utilidade como sistema de alerta e, en cambio, vólvese crónica e debilitante. Esta transición a unha fase crónica implica cambios na medula espiñal e no cerebro, pero tamén hai unha notable modulación onde as mensaxes de dor se inician a nivel da neurona sensorial primaria. Os esforzos para determinar como estas neuronas detectan estímulos que producen dor de natureza térmica, mecánica ou química revelaron novos mecanismos de sinalización e achegáronnos a comprender os eventos moleculares que facilitan as transicións da dor aguda a persistente.
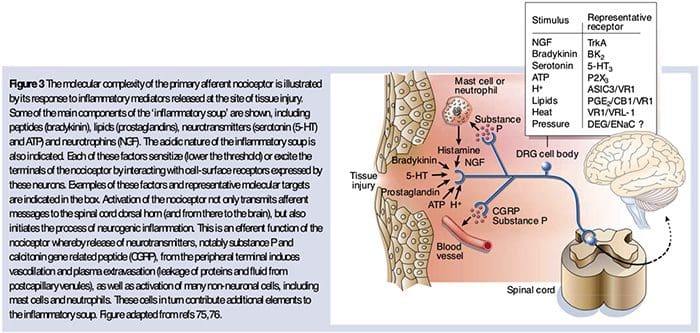 A Neuroquímica dos Nociceptores
A Neuroquímica dos Nociceptores
O glutamato é o neurotransmisor excitatorio predominante en todos os nociceptores. Os estudos histoquímicos do DRG adulto, con todo, revelan dúas grandes clases de fibras C non microelementadas.
Transductores químicos para facer a dor peor
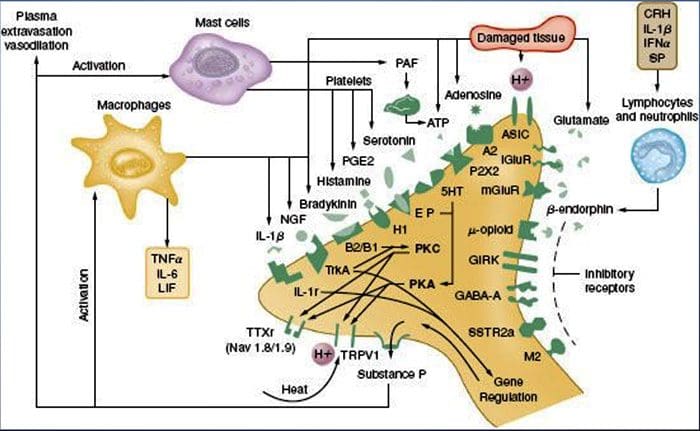
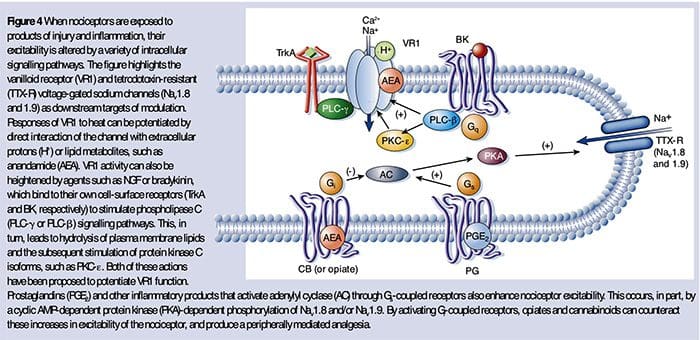
Como descrito anteriormente, a lesión aumenta a nosa experiencia de dor aumentando a sensibilidade dos nociceptores tanto a estímulos térmicos como mecánicos. Este fenómeno resulta, en parte, da produción e liberación de mediadores químicos do terminal sensorial primario e de células non neuraleis (por exemplo, fibroblastos, mastocitos, neutrófilos e plaquetas) no medio36 (Fig. 3). Algúns compoñentes da sopa inflamatoria (por exemplo, protones, ATP, serotonina ou lípidos) poden alterar a excitabilidade neuronal directamente pola interacción con canles iónicos na superficie do nociceptor, mentres que outros (por exemplo, bradiquinina e NGF) únense a receptores metabotrópicos e medie os seus efectos a través de cascadas de sinalización de segundo mensaxeiro11. Levouse a cabo un gran progreso na comprensión da base bioquímica destes mecanismos moduladores.
Protóns extracelulares e acidosis dos tecidos
A acidosis do tecido local é unha resposta fisiolóxica característica da lesión eo grao de dor ou incomodidade asociado está ben correlacionado coa magnitude da acidificación 37. A aplicación de ácido (pH 5) na pel produce descargas sostidas nun terceiro ou máis neciceptores polimodais que inervan o campo receptivo 20.
 Mecanismos celulares e moleculares da dor
Mecanismos celulares e moleculares da dor
Abstracto
O sistema nervioso detecta e interpreta unha ampla gama de estímulos térmicos e mecánicos, así como irritantes químicos ambientais e endóxenos. Cando son intensos, estes estímulos xeran unha dor aguda e, no marco dunha lesión persistente, os compoñentes do sistema nervioso central e periférico da vía de transmisión da dor presentan unha tremenda plasticidade, aumentando os sinais de dor e producindo hipersensibilidade. Cando a plasticidade facilita os reflexos protectores, pode ser beneficioso, pero cando os cambios persisten, pode producirse unha enfermidade crónica. Os estudos xenéticos, electrofisiolóxicos e farmacolóxicos están a aclarar os mecanismos moleculares que subyacen na detección, codificación e modulación de estímulos nocivos que xeran dor.
Introdución: Agudo versus dor persistente
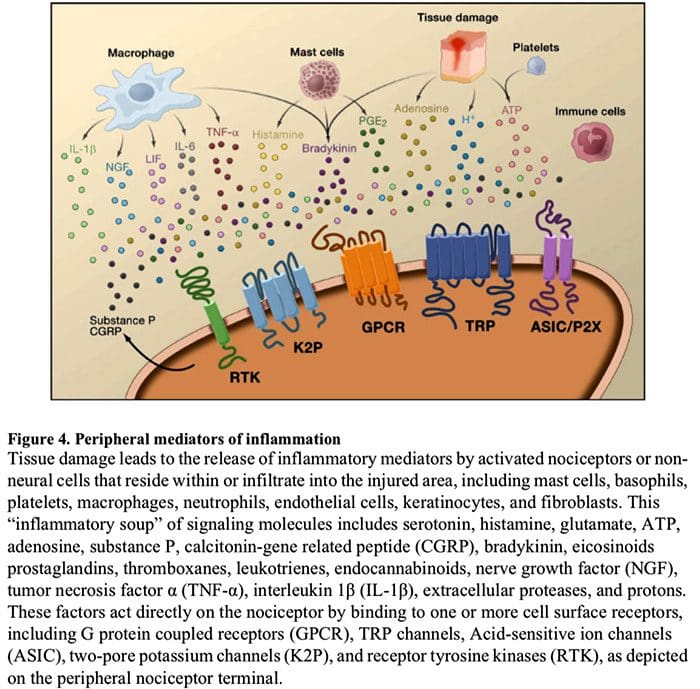
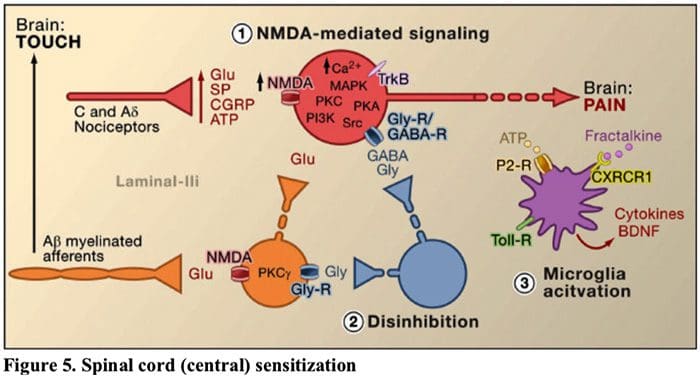 Imaxe 5. Sensibilización da corda espinal (central)
Imaxe 5. Sensibilización da corda espinal (central)
- Sensibilización mediada por receptores de glutamato / NMDA.�Tras unha estimulación intensa ou unha lesión persistente, activáronse C e A? Os nociceptores liberan unha variedade de neurotransmisores, incluíndo dlutamato, substancia P, péptido relacionado co xene da calcitonina (CGRP) e ATP, nas neuronas de saída da lámina I do corno dorsal superficial (vermello). Como consecuencia, os receptores de glutamato NMDA normalmente silenciosos situados na neurona postsináptica agora poden sinalizar, aumentar o calcio intracelular e activar unha serie de vías de sinalización dependentes do calcio e segundos mensaxeiros, incluíndo a proteína quinase activada por mitógenos (MAPK), a proteína quinase C (PKC). , proteína quinase A (PKA) e Src. Esta fervenza de eventos aumentará a excitabilidade da neurona de saída e facilitará a transmisión de mensaxes de dor ao cerebro.
- Disinhibición.�En circunstancias normais, as interneuronas inhibidoras (azul) liberan continuamente GABA e/ou glicina (Gly) para diminuír a excitabilidade das neuronas de saída da lámina I e modular a transmisión da dor (ton inhibidor). Non obstante, no contexto da lesión, esta inhibición pódese perder, o que provoca hiperalxesia. Ademais, a desinhibición pode permitir que A? aferentes primarias para involucrar o circuíto de transmisión da dor de tal xeito que os estímulos normalmente inocuos agora se perciben como dolorosos. Isto ocorre, en parte, a través da desinhibición da PKC excitadora? expresando interneuronas na lámina interna II.
- Activación microglial.A lesión dos nervios periféricos promove a liberación de ATP e a quimiocina fractalquina que estimulará as células da microglia. En particular, a activación dos receptores purinérxicos, CX3CR1 e Toll-like na microglía (púrpura) ten como resultado a liberación de factor neurotrófico derivado do cerebro (BDNF), que mediante a activación dos receptores TrkB expresados polas neuronas de saída da lámina I, promove un aumento da excitabilidade e aumento da dor en resposta á estimulación tanto nociva como inocua (é dicir, hiperalxesia e alodinia). A microglia activada tamén libera unha serie de citocinas, como o factor de necrose tumoral. (TNF?), interleucina-1? e 6 (IL-1?, IL-6), e outros factores que contribúen á sensibilización central.
O medio químico da inflamación
A sensibilización periférica resulta máis comúnmente de cambios asociados á inflamación no ambiente químico da fibra nerviosa (McMahon et al., 2008). Así, o dano tisular adoita acompañarse da acumulación de factores endóxenos liberados de nociceptores activados ou células non neuronais que residen dentro ou se infiltran na área lesionada (incluíndo mastocitos, basófilos, plaquetas, macrófagos, neutrófilos, células endoteliais, queratinocitos e fibroblastos). Colectivamente. estes factores, denominados "sopa inflamatoria", representan unha gran variedade de moléculas de sinalización, incluíndo neurotransmisores, péptidos (substancia P, CGRP, bradiquinina), eicosinoides e lípidos relacionados (prostaglandinas, tromboxanos, leucotrienos, endocannabinoides), neurotrofinas, citocinas , e quimiocinas, así como proteasas e protóns extracelulares. Notablemente, os nociceptores expresan un ou máis receptores da superficie celular capaces de recoñecer e responder a cada un destes axentes proinflamatorios ou proalxéxicos (Figura 4). Estas interaccións melloran a excitabilidade da fibra nerviosa, aumentando así a súa sensibilidade á temperatura ou ao tacto.
Indudablemente, o enfoque máis común para reducir a dor inflamatoria implica a inhibición da síntese ou a acumulación de compoñentes da sopa inflamatoria. Isto é mellor exemplificado por medicamentos antiinflamatorios non esteroideos, como aspirina ou ibuprofeno, que reducen a dor inflamatoria e a hiperalgesia ao inhibir as ciclooxigenasas (Cox-1 e Cox-2) implicadas na síntese de prostaglandinas. Unha segunda aproximación é bloquear as accións dos axentes inflamatorios no nociceptor. Aquí, destacamos exemplos que proporcionan unha nova visión sobre os mecanismos celulares de sensibilización periférica ou que constitúen a base de novas estratexias terapéuticas para tratar a dor inflamatoria.
NGF quizais sexa máis coñecido polo seu papel como factor neurotrófico necesario para a supervivencia e desenvolvemento das neuronas sensoriais durante a embrioxénese, pero no adulto, o NGF tamén se produce no marco da lesión tisular e constitúe un compoñente importante da sopa inflamatoria (Ritner et al., 2009). Entre os seus moitos obxectivos celulares, o NGF actúa directamente nos nociceptores de fibra peptidérxica C, que expresan a tirosina quinasa do receptor NGF de alta afinidade, TrkA, así como o receptor de baixa neurotrofinas de afinidade, p75 (Chao, 2003; Snider e McMahon, 1998). NGF produce unha hipersensibilidade profunda á calor e aos estímulos mecánicos a través de dous mecanismos definidos temporalmente. Nun principio, unha interacción NGF-TrkA activa as vías de sinalización máis baixas, incluíndo a fosfolipase C (PLC), a proteína quinasa activada por mitógeno (MAPK) e a fosfoinositida 3-quinasa (PI3K). Isto dá como resultado a potenciación funcional das proteínas diana no terminal nociceptor periférico, o máis notablemente TRPV1, que conduce a un cambio rápido na sensibilidade térmica celular e conductual (Chuang et al., 2001).
Independentemente dos seus mecanismos pro-nociceptivos, interferir coa sinalización de neurotrofinas ou citocinas converteuse nunha estratexia importante para controlar a enfermidade inflamatoria ou a dor resultante. O enfoque principal implica o bloqueo de NGF ou TNF-? acción cun anticorpo neutralizante. No caso do TNF-?, este foi notablemente eficaz no tratamento de numerosas enfermidades autoinmunes, incluída a artrite reumatoide, o que leva a unha redución dramática tanto da destrución dos tecidos como da hiperalxesia acompañante (Atzeni et al., 2005). Dado que as accións principais do NGF sobre o nociceptor adulto ocorren no contexto da inflamación, a vantaxe deste enfoque é que a hiperalxesia diminuirá sen afectar percepción da dor normal. De feito, os anticorpos anti-NGF están actualmente en ensaios clínicos para o tratamento de síndromes inflamatorios (Hefti et al., 2006).
Sensibilización mediada polo receptor por glutamato / NMDA
A dor aguda sinala a liberación do glutamato desde os terminales centrais dos nociceptores, xerando correntes post-sinápticas excitatorias (EPSC) en neuronas de córner dorsal de segunda orde. Isto ocorre principalmente mediante a activación dos subtipos postsinápticos AMPA e Kainate dos receptores de glutamato ionotrópico. A suma dos EPSC sub-umbrales na neurona postsináptica acabará por provocar o potencial disparo e transmisión da mensaxe de dor a neuronas de maior orde.
Outros estudos indican que os cambios na neurona de proxección, por si mesmos, contribúen ao proceso de inhibición. Por exemplo, a lesión do nervio periférico profunda regula o KCC2 co-transportador K + - Cl, que é esencial para manter gradientes normais de K + e Cl en toda a membrana plasmática (Coull et al., 2003). A descolarización do KCC2, que se expresa nas neuronas de proxección da lámina I, resulta nun cambio no Cl- gradiente, de tal xeito que a activación dos receptores GABA-A despolariza, en lugar de hiperpolarizar as neuronas de proxección lamina I. Isto, á súa vez, aumentará a excitabilidade e aumentará a transmisión da dor. De feito, o bloqueo farmacolóxico ou o downregulation mediada por siRNA de KCC2 na rata induce a alodinia mecánica.
Fontes:
¿Por que me duele o ombreiro? Unha revisión da base neuroanatómica e bioquímica da dor no ombreiro
Benjamin John Floyd Dean, Stephen Edward Gwilym, Andrew Jonathan Carr
Mecanismos móbiles e moleculares da dor
Allan I. Basbaum1, Diana M. Bautista2, Gre?gory Scherrer1 e David Julius3
1 Departamento de Anatomía da Universidade de California, San Francisco 94158
2 Departamento de Bioloxía Molecular e Celular, Universidade de California, Berkeley CA 94720 3 Departamento de Fisioloxía da Universidade de California, San Francisco 94158
Mecanismos moleculares de nocicepción
David Julius* & Allan I. Basbaum�
*Departamento de Farmacoloxía Celular e Molecular, e �Departamentos de Anatomía e Fisioloxía e WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, California 94143, USA (e-mail: julius@socrates.ucsf.edu)
Ámbito de práctica profesional *
A información aquí contenida en "Bioquímica da dor" non pretende substituír unha relación individual cun profesional da saúde cualificado ou un médico licenciado e non é un consello médico. Animámoslle a que tome decisións sobre a saúde baseándose na súa investigación e colaboración cun profesional sanitario cualificado.
Información do blog e debates de alcance
O noso ámbito de información limítase a quiropráctica, músculo-esqueléticos, medicamentos físicos, benestar, contribuíndo etiolóxico trastornos viscerosomáticos dentro de presentacións clínicas, dinámica clínica do reflexo somatovisceral asociado, complexos de subluxación, problemas de saúde sensibles e/ou artigos, temas e discusións de medicina funcional.
Proporcionamos e presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista réxese polo seu ámbito profesional e a súa xurisdición de licenza. Usamos protocolos funcionais de saúde e benestar para tratar e apoiar a atención das lesións ou trastornos do sistema músculo-esquelético.
Os nosos vídeos, publicacións, temas, temas e coñecementos abarcan asuntos clínicos, cuestións e temas relacionados co noso ámbito de práctica clínica e apoian directa ou indirectamente o noso ámbito de práctica.*
A nosa oficina intentou razoablemente proporcionar citas de apoio e identificou o estudo ou estudos de investigación relevantes que apoian as nosas publicacións. Proporcionamos copias dos estudos de investigación de apoio dispoñibles para os consellos reguladores e o público logo de solicitude.
Entendemos que cubrimos asuntos que requiren unha explicación adicional de como pode axudar nun determinado plan de atención ou protocolo de tratamento; polo tanto, para debater máis sobre o tema anterior, non dubide en preguntar Dr. Alex Jiménez, DC, ou póñase en contacto connosco 915-850-0900.
Estamos aquí para axudarche a ti e á túa familia.
Bendicións
Dr. Alex Jiménez ANUNCIO, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenciado como Doutor en Quiropráctica (DC) en Texas & Novo México*
Número de licenza de Texas DC TX5807, New Mexico DC Número de licenza NM-DC2182
Licenciada como enfermeira rexistrada (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (Nº de control 3558029)
Estado compacto: Licenza multiestatal: Autorizado para Practicar en Estados 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
A miña tarxeta de visita dixital







