Tras a transección do nervio periférico do membro superior e a reparación cirúrxica, algúns pacientes recuperan unha boa función sensomotora, mentres que outros non. Comprender os mecanismos periféricos e centrais que contribúen á recuperación pode facilitar o desenvolvemento de novas intervencións terapéuticas. A plasticidade despois da transección do nervio periférico demostrouse ao longo da neuroaxis en modelos animais de lesión nerviosa. Non obstante, non se examinaron os cambios cerebrais que se producen tras a transección do nervio periférico e a reparación cirúrxica en humanos. Ademais, non se caracterizou a medida en que a rexeneración do nervio periférico inflúe nos cambios cerebrais funcionais e estruturais. Polo tanto, preguntamos se os cambios funcionais van acompañados de cambios estruturais de materia gris e / ou branca e se estes cambios están relacionados coa recuperación sensorial? Para tratar estes problemas clave (i) avaliamos a rexeneración do nervio periférico; (ii) medición da resonancia magnética funcional activación cerebral (sinal dependente do nivel de osíxeno no sangue; BOLD) en resposta a un estímulo vibrotáctil; (iii) examinou a plasticidade cerebral estrutural da materia branca e gris; e (iv) medidas de recuperación sensorial correlacionadas con cambios de materia gris en pacientes con transección de nervios periféricos e reparación cirúrxica. En comparación co nervio contralesional saudable de cada paciente, os nervios transectados teñen unha condución nerviosa prexudicada 1.5 anos despois da transección e reparación, conducindo cunha amplitude diminuída e unha maior latencia. En comparación cos controis saudables, os pacientes con transección do nervio periférico e reparación cirúrxica alteraron a actividade do sinal dependente do nivel de osíxeno no sangue nas cortexas somatosensoriais primarias e secundarias contralacionais e nun conxunto de áreas cerebrais coñecidas como a "rede de tarefas positivas". Ademais, identificáronse reducións de materia gris en varias áreas cerebrais, incluíndo a cortiza somatosensorial primaria e secundaria contralesional, nas mesmas áreas onde se identificaron as reducións de sinais dependentes do nivel de osíxeno no sangue. Ademais, o adelgazamento da materia gris no xiro post-central correlacionouse negativamente coas medidas de recuperación sensorial (detección mecánica e de vibracións) demostrando un claro vínculo entre a función e a estrutura. Por último, identificamos unha anisotropía fraccionada de materia branca na ínsula dereita nunha rexión que tamén demostrou unha materia gris reducida. Estes resultados proporcionan información sobre a plasticidade cerebral e as relacións estrutura-función-comportamento tras unha lesión nerviosa e teñen importantes implicacións terapéuticas.
Palabras clave: espesor cortical; fMRI; tensor de difusión; plasticidade; lesión nerviosa periférica
Abreviaturas: BA = área Brodmann; BOLD = dependente do nivel de osíxeno no sangue. fMRI = imaxes de resonancia magnética funcional;
PNIr = transición nerviosa periférica e reparación quirúrgica; S1 = cortiza somatosensorial primaria; S2 = corteza somatosensorial secundaria
Contidos
introdución
Tras a transección do nervio periférico do membro superior e a reparación cirúrxica (PNIr), un 25% dos pacientes non volveron ao traballo 1.5 anos despois da cirurxía (Jaquet et al., 2001). Ademais, un 57% dos pacientes con lesións nerviosas teñen entre 16 e 35 anos (McAllister et al., 1996); así, unha longa vida de discapacidade e dificultades económicas poden acompañar a transección do nervio do membro superior. Comprender as ramificacións centrais e periféricas da lesión do nervio periférico pode facilitar o desenvolvemento de novas estratexias terapéuticas e programas de intervención.
Non se sabe como o cerebro responde ao PNIr en humanos. Non obstante, os estudos en animais establecen que a plasticidade dentro do córtex somatosensorial comeza inmediatamente despois da transición nerviosa periférica, e que 1 ano tras a completa transición nerviosa e reparación quirúrgica, os mapas corticales conteñen representacións irregulares e non continuas dos nervios transectos e adxacentes (Wall et al ., 1986). Os mecanismos que facilitan a plasticidade funcional inclúen a desmontaxe inmediata das proxeccións preexistentes a partir de niveis corticales e subcorticales adxacentes e o crecemento a longo prazo dos axóns a varios niveis da neuroaxis, incluíndo a cortiza somatosensorial primaria (S1) (Florencia e Kaas , 1995; Hickmott e Steen, 2005).
Os estudos de imaxe cerebral humana corroboraron os resultados de modelos animais coa identificación de mapas de activación funcional da MRI alterados debido a lesións na medula espinal, amputación, transferencia toe-to-thumb, e en pacientes con síndrome do túnel do carpelo (Lotze et al., 2001; Manduch et al., 2002; Jurkiewicz et al., 2006; Napadow et al., 2006). Ademais, os estudos estruturais de resonancia magnética recentemente visualizaron cambios de materia gris e branca tras lesións traumáticas e en diversas condicións patolóxicas, incluíndo amputación de extremidades e dor crónica (Apkarian et al., 2004; Draganski et al., 2006; Davis et al., 2008; Geha et al., 2008; May, 2008). Se pensa que os cambios de materia gris están relacionados cos cambios no tamaño celular, a atrofia e / ou a perda das neuronas ou glia, mentres que os cambios na materia branca son afectados pola degeneración axonal e a perda da mielina (Beaulieu, 2002; May, 2008).
Un enfoque potente para delinear mecanismos de patoloxía e plasticidade é combinar técnicas estruturais e estruturais de técnicas de imaxe gris e branca. Anteriormente, informamos que os pacientes con PNIr de membro superior completo conservaban déficits somatosensorios profundos que persisten 41.5 anos despois da cirurxía (Taylor et al., 2008a). Con base nestes achados, razonamos que estes pacientes mostrarían cambios cerebrais estruturais e funcionais en áreas cerebrais somatosensoriales clave. Polo tanto, neste estudo, a hipótese de que os pacientes con PNIr terían: (i) as respostas menores dependentes do nivel de osíxeno no sangue (BOLD) á estimulación vibratoria do territorio nervioso transcutáneo, na rexión de S1 que representa o extremo superior lesionado e no secundario cortiza somatosensorial (S2); (ii) unha redución correspondente no espesor cortical nestas rexións do contralional S1 e S2; (iii) unha correlación entre os cambios no espesor cortical e as medidas psicofísicas da función somatosensorial (trastornos de vibración e detección táctil); e (iv) anisotropía fraccionada reducida (unha medida da integridade da materia branca) na materia branca que se alimenta dentro / fóra destas áreas corticales somatosensoriales.
Methods
Temas
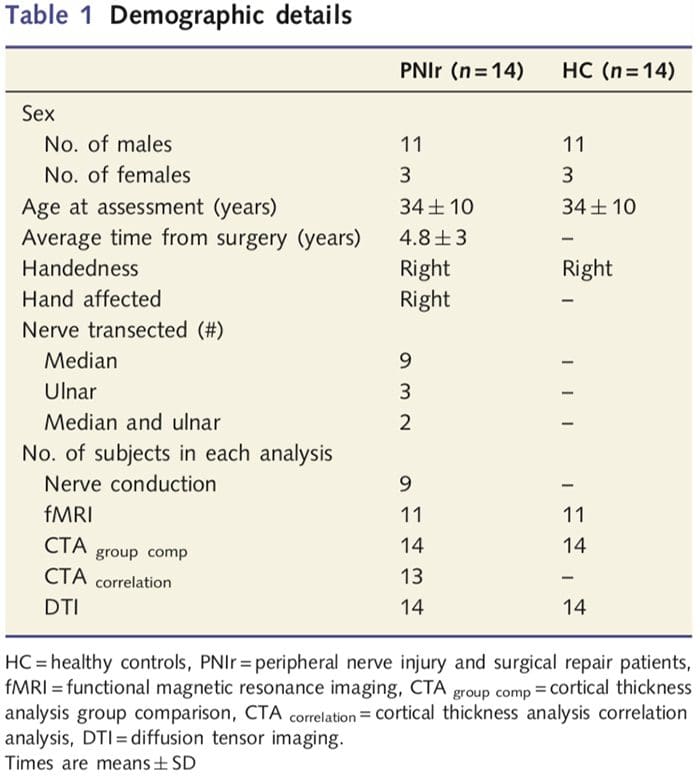
Recrutamos a 27 pacientes con transección completa da mediana e / ou do nervio cubital seguidos de reparación cirúrxica de cirurxiáns plásticos afiliados ao Programa de mans da Universidade de Toronto entre xuño de 2006 e maio de 2008. Desta cohorte máis grande, 14 pacientes sen dor (tres mulleres) , 11 homes; 34-10 anos) con transección completa da mediana dereita e / ou do nervio cubital incluíronse no estudo [para evitar confusións relacionadas coa presenza de dor e lateralidade pacientes con dor (n = 6) e lesións cara esquerda (n = 7) foron excluídos desta análise]. Todos os pacientes sometéronse a unha reparación microcirúrxica do nervio polo menos 1.5 anos antes da inscrición no estudo (o tempo de recuperación variou de 1.5 a 8 anos). Ademais, contratamos 14 controis saudables de idade e sexo (3 femias, 11 homes; 34-10 anos). Todos os suxeitos deron o consentimento informado por escrito aos procedementos aprobados polo Consello de Ética da Investigación da Rede de Saúde da Universidade. Todos os suxeitos foron mans dereitas (determinadas mediante o inventario de mans de Edimburgo: Oldfield, 1971) e non tiñan antecedentes de lesións neurolóxicas nin dor crónica (nin antes nin despois da transección nerviosa). Vexa a táboa 1 para detalles demográficos.
deseño do estudo
Todos os suxeitos participaron nunha sesión de imaxe que incluía: (i) a resonancia magnética funcional (fMRI) en resposta aos estímulos vibrotactiles aplicados ao dedo índice dereito (dentro do territorio nervioso medio); (ii) un escaneo anatómico de alta resolución do cerebro enteiro, adquirido para o rexistro de imaxes e para a análise da materia gris cortical; e (iii) dous escaneos de imaxe de tensor de difusión para a avaliación da integridade da materia branca. Antes da imaxe, os suxeitos foron instruídos no deseño básico do experimento e recordaron que permanecería o máis posible durante toda a duración da comprobación.
Os suxeitos foron libres para retirarse do estudo en calquera momento. Ademais, realizouse unha avaliación sensorial e motora para todos os temas (Taylor et al., 2008a). A medida que os limiares de detección de táctil e vibración foron correlacionados co grosor cortical, inclúese unha descrición destes métodos (outras medidas psicofísicas serán reportadas noutro lugar).
Límite de vibración
Os limiares de detección de vibracións foron determinados usando un Bio-Thesiometer (Bio-Medical Instrument Company, EUA). O dispositivo ten unha sonda 12-mm que foi colocada na falange distal do dedo índice dereito (D2). Os limiares determináronse utilizando o método de límites: a amplitude (tensión) aumentou gradualmente ata que o suxeito indicaba que percibían o estímulo. Os límites de vibración foron adquiridos tres veces e calculouse un valor medio. Durante as probas de umbral de vibración, os suxeitos encargáronse de pechar os ollos e descansar a parte traseira da man sobre un coxín de apoio.
Límite de detección mecánica
Os limiares de detección mecánica determináronse empregando un conxunto estandarizado de filamentos de von Frey (OptiHair2 Marstock Nervtest, Alemaña) que conteñen 12 filamentos calibrados espaciados logaritmicamente que entregaron forzas desde 0.25-512 mN. O diámetro da superficie de contacto dos 12 filamentos era de ~ 0.4 mm. Os ensaios realizáronse cos ollos do suxeito pechados e as mans apoiadas nun coxín suave. As sondas aplicáronse nunha serie ascendente e os suxeitos tiñan que responder cada vez que sentían que unha sonda tocaba a punta do dedo D2 dereita. Este proceso repetiuse tres veces. A forza do filamento que se detectou en polo menos dous dos tres ensaios informouse como o limiar de detección mecánica do suxeito.
Probas de conduta nerviosa
Os pacientes participaron en estudos bilaterais de condución sensorial e nerviosa motora na clínica de electromiografía (EMG) do Toronto Western Hospital. Para a condución do nervio motor, o electrodo estimulante colocouse no pulso e no cóbado (por separado) e o electrodo de gravación colocouse sobre o abdutor pollicis brevis, para a avaliación do nervio mediano ou o abdutor digiti minimi para a avaliación do nervio cubital. Para a proba do nervio sensorial, o electrodo de gravación colocouse no pulso e o electrodo estimulante colocouse nos díxitos D2, D3 e D5. Un neurólogo experimentado da clínica EMG de Toronto Western Hospital (doutor Peter Ashby) revisou todas as avaliacións clínicas para determinar que nervios demostraron respostas normais / anormais. Como se sabe que as medidas de amplitude e latencia varían substancialmente entre suxeitos (debido a factores como a densidade de inervación, a profundidade do nervio e o grosor da pel dun suxeito individual) (Kimura, 2001), o nervio non transectado de cada paciente serviu como control propio para a comparación cos valores do lado transeccionado. Naqueles pacientes con respostas de condución nerviosa detectables, realizáronse probas t emparelladas para avaliar a diferenza nas medidas de latencia ou amplitude entre os nervios transectados e contralacionais de cada paciente.
Parámetros de imaxe
Os datos de imaxes cerebrais foron adquiridos mediante un sistema de resonancia magnética 3T GE equipado cunha bobina de cabeza de matriz en fase de oito canles. Os suxeitos colocáronse en decúbito supino sobre a mesa de resonancia magnética e a cabeza de cada suxeito foi acolchada para reducir o movemento. Os datos de fMRI de todo o cerebro foron adquiridos mediante imaxes de eco plano (28 cortes axiais, campo de visión (FOV) = 20 x 20 cm, matriz 64 x 64, vóxeles de 3.125 x 3.125 x 4 mm, tempo de eco (TE) = 30 ms, repetición tempo (TR) = 2000 ms). O tempo de exploración foi de 5 min e 8 s (154 fotogramas). Durante a exploración, aplicouse un estímulo vibrotáctil non doloroso de 12 Hz á falanxe distal da D2 dereita usando diafragmas de globo impulsados por aire comprimido (Dispositivo fabricado polo Dr Christo Pantev; www.biomag.uni-muenster.de). Os estímulos entregáronse en bloques de 10 segundos entrelazados con 20 segundos de repouso, para un total de 10 bloques de estimulación e 10 bloques de repouso. Os primeiros 8 s (4 TRs) de datos adquiridos de cada carreira descartáronse para permitir o equilibrio do sinal de fMRI. Os suxeitos foron instruídos para manter os ollos pechados durante a exploración e concentrarse nos estímulos. Adquiriuse unha exploración anatómica de alta resolución tridimensional (3D) do cerebro enteiro (124 cortes saxitais, 24 x 24 cm FOV, 256 x 256 matriz, 1.5 x 0.94 x 0.94 mm vóxeles) cun gradiente de secuencia 1D alterada ponderada en T3. (media dun sinal, ángulo de inflexión = 20? , TE ? 5 ms). Ademais, adquiríronse dúas exploracións de imaxes de tensor de difusión (38 cortes axiais, FOV 24 x 24 cm, 128 x 128 matriz, 1.875 x 1.875 x 3 mm voxels) ao longo de 23 direccións cun valor b de 1000smm². Cada tirada tamén contiña dous volumes sen ponderación de difusión.
Análise fMRI
Os datos foron analizados mediante Brainvoyager QX v1.8 (Brain Innovaton, Maastricht, Holanda). O procesamento previo incluíu: corrección de movemento 3D, corrección de tempo de escaneo de corte, eliminación de tendencias lineal, filtrado de paso elevado (cinco ciclos por execución) e alisado espacial cun ancho completo de 6mm ao medio kernel gaussiano (FWHM) máximo. Os conxuntos de datos fMRI foron interpolados a voxels 3 x 3 x 3 mm, rexistrados na imaxe analítica de alta resolución e normalizados ao espazo Talairach estándar (Talairach e Tournoux, 1988). Voxels denomínanse 1 x 1 x 1 mm. Os datos foron analizados usando o modelo lineal xeral; o modelo obtívose convolvendo a función boxcar do curso de tempo da estimulación táctil coa función de resposta hemodinámica estándar. Para identificar entre as diferenzas do grupo nos patróns de activación realizouse unha análise de efectos fixos cos contrastes: (i) controis saudables: descanso 4 de estimulación; (ii) PNIr: descanso 4 de estimulación; e (iii) controis saudables 4 PNIr. Os mapas de activación foron reducidos a un valor correcto de P50.05 (derivado dun Voxels contiguos P50.0001 e 120mm3 non corrixidos como se informou anteriormente: Taylor e Davis, 2009); isto tamén foi validado executando unha simulación Monte Carlo con aplicación AlphaSim implementada no software Análise de Neuroimagen Funcional (AFNI). Esta análise incluíu só os pacientes 11 que sostiveron a transición do nervio mediano dereito (n = 9) ou a mediana dereita e nervio cubital (n = 2) (é dicir, os tres pacientes con transción pura do nervio cubital dereito non foron incluídos nesta análise ).
Análise de grosor cortical
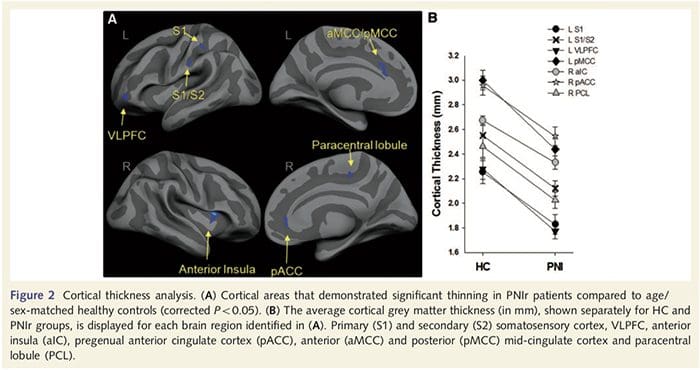
A análise do grosor cortical realizouse usando Freesurfer (http: // surfer.nmr.mgh.harvard.edu); os métodos expuxéronse en detalle noutros lugares (Dale et al., 1999; Fischl et al., 1999a, b; Fischl e Dale 2000). En breve, rexistráronse conxuntos de datos anatómicos ponderados en T1 de alta resolución no atlas de Talairach (Talairach e Tournoux, 1988). A continuación seguiu a normalización da intensidade, a pelada do cranio e a separación dos hemisferios. Posteriormente identificáronse e segmentáronse os límites da materia branca / gris (chamada superficie branca) e gris / LCR (chamada superficie pial). A distancia entre as superficies branca e pial calculouse entón en cada punto de cada hemisferio cerebral. Para identificar as diferenzas de grupo entre os 14 pacientes e os 14 controis de idade / sexo, realizouse unha análise xeral do modelo lineal en todos os puntos do cerebro. Como a topografía cortical individual é inherentemente heteroxénea, aplicouse un núcleo de alisado espacial de 5 mm FWHM antes da análise estatística. Os datos móstranse nun P50.05 corrixido (derivado dun P50.0075 non corrixido e 102 vértices contiguos); isto calculouse executando unha simulación de Monte Carlo con AlphaSim. Un vértice representa un punto nunha folla bidimensional e, neste estudo, a distancia entre dous vértices é de 0.80 mm2.
A medida que os pacientes presentaban déficits significativos na función somatosensorial dentro do territorio nervioso transectado, fixemos a hipótese de que as medidas da función somatosensorial (detección de vibracións e tacto) correlacionaríanse co espesor cortical no xiro contralesional post-central (cortexos somatosensoriais primarios e secundarios). Polo tanto, realizamos análises de correlación no grupo de pacientes entre: (i) espesor cortical e limiar de detección de vibracións; e (ii) limiares de detección de espesor e tacto cortical. Un paciente non completou a avaliación psicofísica; polo tanto, esta análise incluíu 13 pacientes con PNIr. Ademais, para determinar se houbo unha relación entre o espesor cortical e o tempo de recuperación tamén se realizou unha análise de correlación entre estas dúas medidas. Estas análises de correlación restrinxíronse ao xiro contralesional postcentral ao incluír unha máscara (tomada do atlas incorporado de Freesurfer) no modelo lineal xeral. Realizouse unha simulación de Monte Carlo que estaba restrinxida ao número de vértices dentro do xiro contralocional postcentral; as imaxes móstranse cun P50.05 corrixido (derivado dun P50.0075 non corrixido e 68 vértices contiguos).
Análise de imaxe de tensor de difusión
O procesamento de imaxe tensorial de difusión realizouse con DTiStudio (www.MriStudio.org) e FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). As imaxes reasináronse por primeira vez coa ferramenta de rexistro automático de imaxes implementada en DTiStudio, usando a primeira imaxe B0 da primeira serie adquirida como modelo. Este proceso correxe o movemento do suxeito e a distorsión da corrente de Foucault. Todas as imaxes inspeccionáronse visualmente para avaliar a calidade da imaxe e o aliñamento das tiradas de imaxe separadas por tensores de difusión. Se se detectou un artefacto, eliminouse a porción antes de calcular a media das dúas tiradas de imaxe separadas por tensores de difusión. Os mapas FA individuais calculáronse empregando a ferramenta DTIFIT implementada en FSL. Realizouse unha análise estatística en función de Voxel para identificar as diferenzas de grupo na anisotropía fraccionada media usando estatísticas espaciais baseadas en tractos; para unha descrición completa destes métodos vexa Smith et al. (2006). En breve, as imaxes rexistráronse de forma non lineal nunha imaxe de destino (MNI152), a imaxe media creouse a partir de todos os conxuntos de datos e posteriormente esta imaxe diluíuse para representar todos os tramos comúns a todos os suxeitos. Os valores máis altos de anisotropía fraccionada de cada suxeito proxectáronse entón sobre o esqueleto buscando en materia branca perpendicular a cada punto do esqueleto de materia branca. A continuación realizouse unha análise estatística de voxel de cerebro enteiro entre grupos (14PNIr e 14 controis saudables) e as imaxes corrixíronse no cerebro enteiro en P50.05. Ademais, realizouse unha análise de rexións de interese na materia branca tramos adxacente ao S1 contralateral, tálamo e insula bilateral anterior e posterior. Estas rexións foron escollidas xa que foron implicadas anteriormente en aspectos de somatosensación e porque se corresponden con rexións que se identificaron na análise de grupos de análise de espesor cortical e fMRI (CTA). As rexións de interese foron debuxadas sobre o esqueleto de materia branca do seguinte xeito: (i) A rexión contralateral de S1 de interese orixinouse medialmente na unión entre o esqueleto de materia branca da corona-radiata ea sección esquelética que se alimenta no xiro post-central; Terminando ao final do tramo dentro dunha porción dada.
Na dirección z a rexión de interese estendeuse de z = 49 a 57; tractos de materia branca que subministran a rexión da man. (ii) A rexión de tálamo contralateral de interese restrinxíase ás pistas de materia branca que rodeaban os núcleos talámicos posteriores e mediais (núcleos implicados na función somatosensorial), que se estendían desde z = 1 ata 4. (iii) As rexións insulares de interese debuxábanse bilateralmente materia branca adxacente á illa anterior e posterior baseada en criterios publicados previamente polo noso laboratorio (Taylor et al., 2008b). A rexión de interese estendeuse de z = 2 a 8. Os valores fraccionarios de anisotropía extraéronse de cada unha destas rexións de interese e realizouse unha análise multivariante de varianza (MANOVA) usando o Paquete estatístico para as ciencias sociais v13.0 (SPSS Inc, Chicago), que incluía valores fraccionados de anisotropía para as seis rexións de interese.
Resultados
A táboa 1 ofrece detalles demográficos para os participantes no estudo. Os 14 pacientes sufriron unha transección completa da mediana dereita e / ou do nervio cubital seguida dunha reparación microcirúrxica polo menos 1.5 anos antes da inscrición no estudo. O tempo desde a cirurxía ata as probas oscilou entre 1.5 e 8 anos cunha media (? DE) de 4.8? 3 anos. Os pacientes e os controis non o fixeron (34-10 anos ambos grupos; t = 0.04; P = 0.97).
Psicofísica
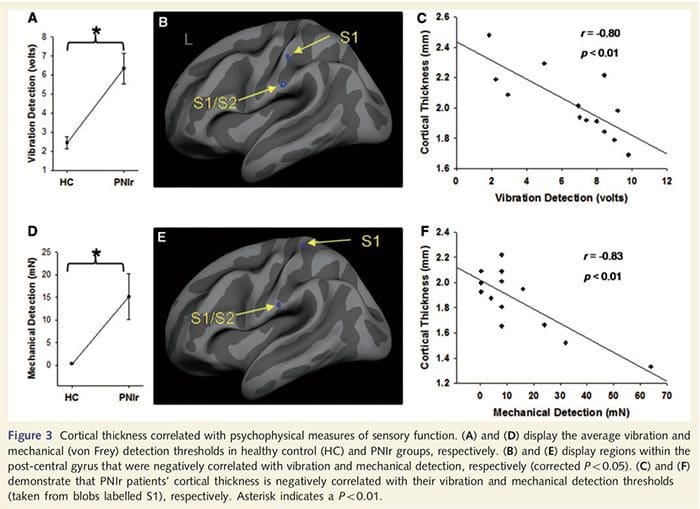
Os limiares de vibración foron calculados a partir das tres medicións xa que a análise de variacións repetidas de varianza (ANOVA) non indicou diferenzas significativas entre os tres ensaios [F (25, 1) = 0.227, P = 0.64]. Os trastornos de vibración e detección mecánica foron significativamente prexudicados nos pacientes PNIr en comparación cos controis sans (vibración: t = 4.77, P50.001, Fig. 3A; mecánica: t = 3.10, P = 0.005, Fig. 3D).
Probas de conduta nerviosa
Un neurólogo con experiencia na clínica EMG de Toronto Western Hospital clasificou as medidas de amplitude e latencia obtidas dos nervios contralesionais de cada paciente como normais. Nove dos 14 pacientes completaron as probas de condución nerviosa. A táboa 2 mostra os datos de latencia e amplitude de aumento / diminución medios para a condución do nervio sensorial desde o pulso ata os músculos abdutor pollicis brevis (mediana) ou abdutor digiti minimi (cubital) e para a condución sensorial desde o pulso ata D2 (mediana) e D5 ( cubital) en comparación con cada paciente nervio contralesional sen lesións. De nove, sete pacientes tiñan transeccións que incluían o nervio mediano. Destes sete, un paciente non tivo resposta detectable durante as probas motoras e outro paciente non tivo resposta detectable durante as probas sensoriais.
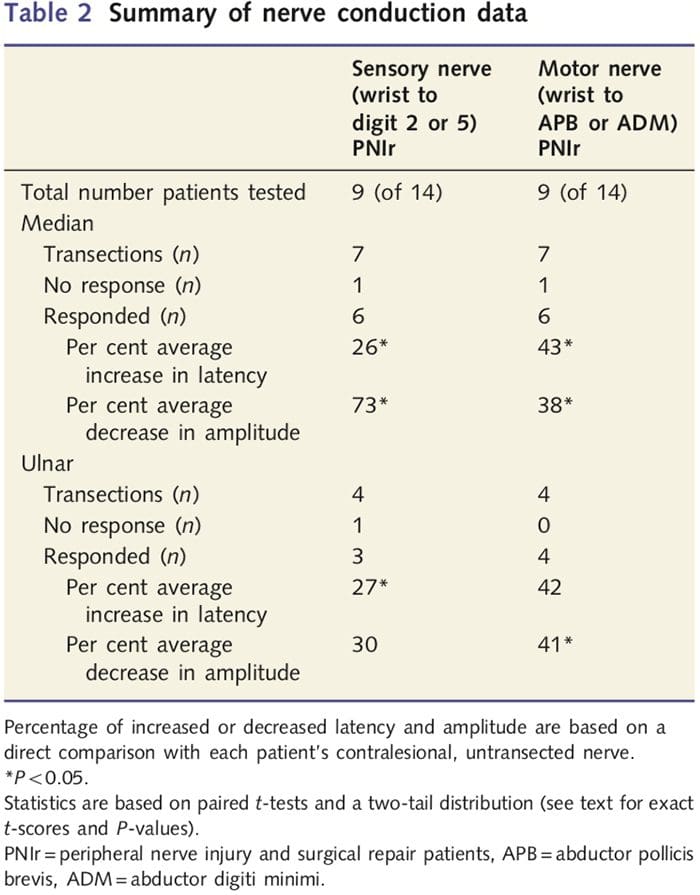 Nos seis pacientes con respostas detectables, as latencias de condución motora aumentaron un 43% (t = 6.2; P = 0.002) e as amplitudes diminuíron un 38% (t = 2.6; P = 0.045) cando o nervio transeccionado de cada paciente era en comparación co seu lado non lesionado. A condución sensorial nos nervios medianos tamén revelou un aumento do 26% na latencia (t = 3.9; P = 0.011) e unha diminución do 73% na amplitude (t = .8.0; P = 0.000) en comparación cos nervios contralesionais normais. Nos catro pacientes con transeccións do nervio cubital un paciente non tivo resposta detectable durante as probas do nervio sensorial. Neses pacientes con respostas, as latencias motoras do nervio cubital non se elevaron significativamente (t = 2.8; P = 0.070); con todo, as amplitudes foron significativamente
Nos seis pacientes con respostas detectables, as latencias de condución motora aumentaron un 43% (t = 6.2; P = 0.002) e as amplitudes diminuíron un 38% (t = 2.6; P = 0.045) cando o nervio transeccionado de cada paciente era en comparación co seu lado non lesionado. A condución sensorial nos nervios medianos tamén revelou un aumento do 26% na latencia (t = 3.9; P = 0.011) e unha diminución do 73% na amplitude (t = .8.0; P = 0.000) en comparación cos nervios contralesionais normais. Nos catro pacientes con transeccións do nervio cubital un paciente non tivo resposta detectable durante as probas do nervio sensorial. Neses pacientes con respostas, as latencias motoras do nervio cubital non se elevaron significativamente (t = 2.8; P = 0.070); con todo, as amplitudes foron significativamente
diminuíu un 41% (t = �5.9; P = 0.010). As probas sensoriais do nervio cubital demostraron un aumento do 27% na latencia (t = 4.3; P = 0.049) pero ningún aumento significativo da amplitude (t = 3.5; P = 0.072).
Plasticidade funcional na cortex somatosensorial primaria
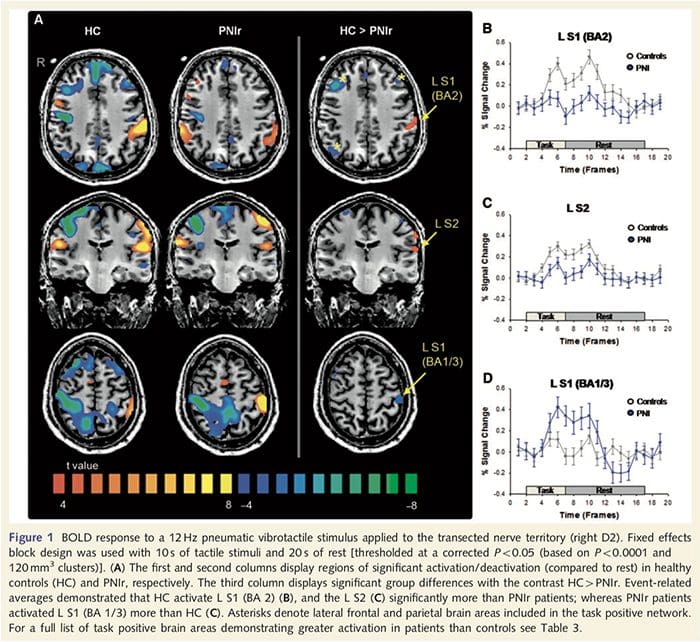
Os mapas funcionais de resonancia magnética foron calculados a partir dos 11 pacientes con PNIr con transeccións nerviosas medianas dereita (os pacientes con transeccións do nervio cubital foron excluídos desta análise) e 11 controis saudables de idade e sexo. Na figura 1A, está claro que os pacientes con PNIr teñen unha activación significativamente menor, en comparación cos controis sans, nunha rexión de S1 correspondente á área de Brodmann 2 (BA2) (Talairach e Tournoux, 1988) e S2 (ver táboa 3 para máis detalles) . As respostas medias relacionadas co evento destas rexións de interese resaltan a resposta BOLD atenuada dentro dos pacientes á esquerda de BA2 e á esquerda de S2 (fig. 1B e C, respectivamente). Curiosamente, a estimulación vibrotáctil nos pacientes activou unha parte máis superior do xiro post-central (probablemente BA1 / 3) (Talairach e Tournoux, 1988) (Fig. 1A e Táboa 3). Unha media relacionada cos eventos (Fig. 1D) demostra que os controis saudables tiveron unha activación mínima nesta rexión. Ademais, os pacientes tiveron unha activación significativamente maior en rexións cerebrais coñecidas colectivamente como a rede de tarefas positivas (asteriscos na figura 1). Vexa a táboa 3 para ver a lista completa das áreas cerebrais positivas activadas. Esta rede inclúe cortiza temporal prefrontal lateral, parietal lateral, premotora e inferior (Táboa 3): áreas cerebrais que se activan durante o desempeño dunha tarefa que esixe atención e suprimidas ou inactivas durante o descanso ou tarefas que non resultan desafiantes cognitivamente ou atentamente (Fox et al., 2005; DeLuca et al., 2006; Seminowicz e Davis 2007).
Materia gris reducida na cortex somatosensorial primaria correlaciona coa recuperación sensorial
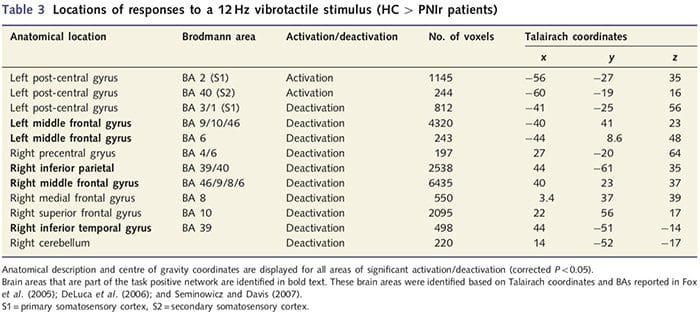
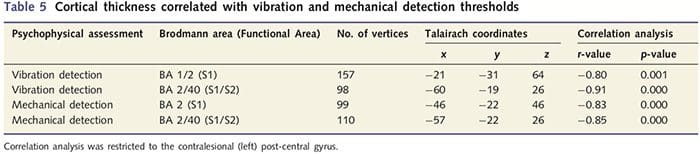
A análise do grosor cortical nos 14 pacientes e 14 controis sans con idade / sexo revelou varios loci de adelgazamento cortical significativo no grupo PNIr (Fig. 2 e Táboa 4). Especificamente, os pacientes tiveron unha redución do 13% ao 22% no espesor cortical na esquerda (contralesional) S1, S2, xiro cingulado anterior pregenual, córtex prefrontal ventrolateral e insula anterior dereita, xiro cingulado medio anterior / posterior e lóbulo paracentral. Curiosamente, as localizacións da materia gris adelgazamento dentro do xiro post-central coinciden coas rexións de BOLD reducido despois da estimulación vibrotáctil (táboa 4). Dado que tiñamos coñecemento previo dos déficits sensoriais e do tempo de recuperación dos pacientes (é dicir, o tempo transcorrido desde a reparación microcirúrxica), preguntamos a continuación se o grosor cortical dos pacientes no xiro post-central se correlacionaba cos seus limiares sensibles de detección de vibracións e mecánica ou cos seus tempo de recuperación. Estas análises revelaron unha correlación negativa entre os limiares de detección de espesor cortical e vibracións nunha rexión que abrangue BA1 / 2 e S2 (P50.001, r =? 0.80 e? 0.91, para BA1 / 2 e S2, respectivamente; Fig. 3 e Táboa 5 ). Ademais, os limiares de detección mecánica tamén se correlacionaron negativamente co espesor cortical nunha rexión BA2 lixeiramente superior e na mesma rexión S2 (P50.001, r =? 0.83 e? 0.85, para BA2 e S2, respectivamente; Fig. 3 e Táboa 5). Non obstante, non identificamos unha relación significativa entre o tempo de recuperación e o grosor cortical. Polo tanto, no xiro post-central o adelgazamento cortical asociouse a déficits sensoriais máis graves. Non obstante, non identificamos unha relación significativa entre o tempo de recuperación e o grosor cortical. Unha vez máis, houbo unha correspondencia entre o adelgazamento cortical en áreas negativamente correlacionadas con estímulos vibratorios e as rexións que mostraban anomalías de fMRI e CTA do grupo.
Anormalidades da materia branca tras a transición nerviosa
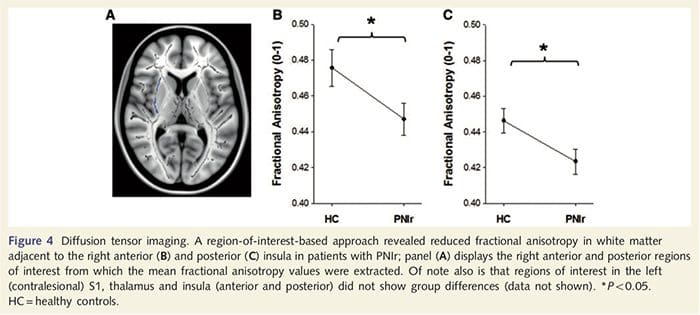
Para avaliar a integridade da materia branca utilizamos un enfoque de interese da área para analizar as diferenzas do grupo de materias brancas en base a hipóteses a priori. As rexións de interese foron restrinxidas a áreas de materia branca que rodean e alimentan o S1 e tálamo contralional. Ademais, tamén debuxamos rexións de interese en materia branca adxacentes á esquerda e á dereita, á anterior e posterior insula. A illa foi elixida xa que está implicada no procesamento somatosensorial e porque identificamos a redución da materia gris no dereito insular anterior con CTA. Esta visión da rexión de interese revelou que os pacientes reduciron significativamente os valores de anisotropía fraccionada da materia branca (MANOVA incluíndo as seis rexións de interese) adxacentes ao anterior dereito [F (1, 26) = 4.39, P = 0.046; Fig. 4A] e insula posterior [F (1, 26) = 5.55, P = 0.026; Fig. 4B], pero non houbo diferenzas grupales na materia branca adxacente á insula esquerda (insula anterior esquerda: P = 0.51; insula esquerda posterior: P = 0.26), tálamo (P = 0.46) ou S1 (P = 0.46 ).
 Conversa
Conversa
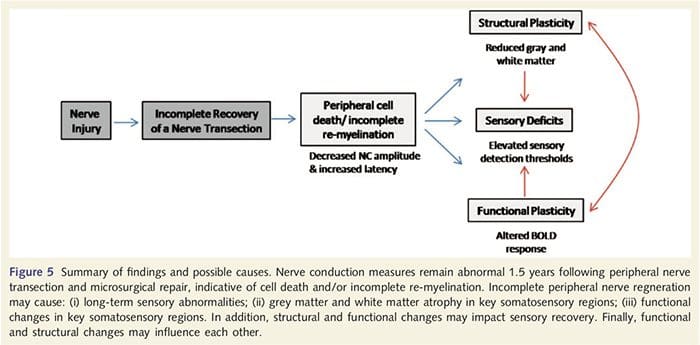
Aquí, demostrouse por primeira vez que hai plasticidade funcional e anomalías estruturais de materia gris e branca en varias áreas corticales tras a transición do nervio periférico das extremidades superiores e a reparación quirúrgica. Esta plasticidade pode xurdir da rexeneración do nervio periférico incompleta (morte celular periférica e / ou re-mielinación incompleta), xa que as medidas de conducción nerviosa nestes pacientes demostraron anormalidades graves. Ademais, os nosos datos demostran que a diminución das respostas de fMRI evocadas por vibrotátil no xiro post-central correspóndese coa redución da materia gris no grupo de pacientes. Estes resultados suxiren que as respostas reducidas de BOLD poden ser facilitadas por unha redución da materia gris cortical e / ou unha diminución da entrada aferente ao xiro post-central. Ademais, o espesor cortical dentro destas mesmas partes do xiros post-central correlaciona negativamente con medidas de comportamento da función somatosensorial. É dicir, o incremento dos déficits somatosensoriales correlacionábanse cun córtex máis delgado; os dous poden estar relacionados coa entrada aferente. En conxunto, os nosos datos suxiren que a regeneración do nervio periférico incompleta contribúe a deficiencias somatosensoriales, atrofia da materia gris cortical e unha redución da activación da fMRI (vexa a figura 5 para un resumo destes achados).
É sabido que a plasticidade cortical tras a transición nerviosa periférica e a reparación quirúrgica pode ocorrer en todo o CNS en primates non humanos (Kaas, 1991). Esta plasticidade está pensada para a desenmascaración de sinapses previamente silenciosas ou brotación axonal nun territorio desmotivado (Wall et al., 1986, Florence e Kaas, 1995). No modelo primate, ano 1 tras a transición nerviosa e a reparación quirúrgica, o córtex denervado caracterízase por representacións incompletas e desordenadas dos nervios rexenerados e adxacentes (intactos). Esta representación irregular é atribuída a unha regeneración periférica incompleta que resulta nunha recuperación parcial do espazo cortical denervado (Kaas, 1991). Para avaliar a extensión da rexeneración periférica na nosa poboación, realizamos estudos de conducción nerviosa sensorial e motora a través da área transectada. Os nosos resultados de condución nerviosa demostran que os pacientes con PNIr teñen unha diminución significativa da amplitude e aumento da latencia tanto nos nervios sensoriais coma nos nervios motores en comparación co seu lado non transitado. A diminución da amplitude combinada cun incremento de latencia é indicativo de perda de fibra periférica (ou sexa, morte celular) e / ou re-mielinización anormal ou incompleta tras a transición (Kimura, 1984). Ademais, está ben establecido que entre 20% e 50% das neuronas ganglionares de raíz dorsal morren tras a transición nerviosa (Liss et al., 1996). Así, a morte da célula aferente ea rexeneración incompleta pode producir unha disminución da entrada aferente ao córtex, o que pode representar déficits sensoriais en curso e diminuír a resposta de BOLD en BA2 e S2. Ademais, esta diminución da entrada aferente tamén pode explicar o desbaste cortical que observamos nas mesmas rexións do córtex. A privación sensorial demostrou causar dexeneración transneuronal en varias rexións do SNC, incluíndo a corno dorsal seguinte á sección nerviosa ciática (Knyihar-Csillik et al., 1989) e pode implicar neuronas de segunda e terceira orde (Powell e Erulkar, 1962). A dexeneración transneuronal caracterízase pola contracción da célula e está relacionada coa diminución da entrada aferente ou non existente (Knyihar-Csillik et al., 1989). Así, a perda da materia gris cortical (ou atrofia) tamén podería estar directamente relacionada coa disminución da entrada aferente.
 Tamén demostrou unha maior activación no xiro post-central nunha rexión correspondente a BA1 / 3 (Talairach e Tournoux, 1988). Os estudos electrofisiolóxicos, de seguimento anatómico e de neuroimagen establecen que, para a maioría dos afeccionados mecanoreceptivos cutáneos, as primeiras destinacións corticales son BA1 e BA3b. Estas áreas citoarquitectonicas cerebrais teñen un mapa corporal somatotópico con pequenos campos receptivos. Ademais, estas áreas responden a moitas características da información táctil, como textura e rugosidade, velocidade e curvatura dos estímulos (Bodegard et al., 2001). Os estudos de fMRI demostraron que a actividade dentro do córtex somatosensorial está influenciada pola atención de xeito que as respostas fMRI aos estímulos táctiles en S1 aumentan cando os individuos atenden a un estímulo táctil, pero se atreven cando os individuos se distraen (Arthurs et al., 2004; Porro et al., 2004). Ademais, os nosos pacientes activaron unha rede de áreas cerebrais coñecida como a rede positivo (DeLuca et al., 2006) máis que controis saudables. Estas áreas cerebrais son activadas durante os procesos esixentes de atención (Fox et al., 2005; Seminowicz e Davis, 2007). Xuntos, estes descubrimentos implican que os pacientes deben atender ao estímulo máis que os controis debido á súa insuficiente entrada sensorial. Esta maior atención tamén pode explicar a maior activación en BA1 / 3b. Por suposto, a maior activación en BA1 / 3b tamén pode reflectir a plasticidade que non está relacionada coa carga atenta.
Tamén demostrou unha maior activación no xiro post-central nunha rexión correspondente a BA1 / 3 (Talairach e Tournoux, 1988). Os estudos electrofisiolóxicos, de seguimento anatómico e de neuroimagen establecen que, para a maioría dos afeccionados mecanoreceptivos cutáneos, as primeiras destinacións corticales son BA1 e BA3b. Estas áreas citoarquitectonicas cerebrais teñen un mapa corporal somatotópico con pequenos campos receptivos. Ademais, estas áreas responden a moitas características da información táctil, como textura e rugosidade, velocidade e curvatura dos estímulos (Bodegard et al., 2001). Os estudos de fMRI demostraron que a actividade dentro do córtex somatosensorial está influenciada pola atención de xeito que as respostas fMRI aos estímulos táctiles en S1 aumentan cando os individuos atenden a un estímulo táctil, pero se atreven cando os individuos se distraen (Arthurs et al., 2004; Porro et al., 2004). Ademais, os nosos pacientes activaron unha rede de áreas cerebrais coñecida como a rede positivo (DeLuca et al., 2006) máis que controis saudables. Estas áreas cerebrais son activadas durante os procesos esixentes de atención (Fox et al., 2005; Seminowicz e Davis, 2007). Xuntos, estes descubrimentos implican que os pacientes deben atender ao estímulo máis que os controis debido á súa insuficiente entrada sensorial. Esta maior atención tamén pode explicar a maior activación en BA1 / 3b. Por suposto, a maior activación en BA1 / 3b tamén pode reflectir a plasticidade que non está relacionada coa carga atenta.
 BA2 e S2 reciben proxeccións de BA1 / 3b e tamén de distintas partes do complexo talámico ventroposterior (Pons et al., 1985; Friedman e Murray, 1986). Ambos cerebro as áreas teñen campos receptivos grandes, a miúdo de varios díxitos (BA2) ou bilaterais (S2) (Pons et al., 1985; Iwamura et al., 2002). Baseado en proxeccións anatómicas e propiedades de resposta neuronal, demostrouse o procesamento xerárquico da información táctil desde BA1 / 3b ata BA 2 (Kaas et al., 2002). Ademais, estudos electrofisiolóxicos en macacos (Pons et al., 1987) e datos de magnetoencefalografía adquiridos en humanos, suxiren que o procesamento en serie de entradas táctiles ocorre de S1 a S2 en primates superiores (Frot e Mauguiere 1999; Disbrow et al. ., 2001). Varios estudos demostraron que o BA2 está preferentemente activado pola forma e a curvatura (Bodegard et al., 2001), mentres que o S2 pode estar implicado na aprendizaxe táctil (Ridley e Ettlinger 1976; Murray e Mishkin, 1984), apoiando a noción de que estas áreas cerebrais están implicados no procesamento somatosensorial de orde superior. A nosa avaliación psicofísica demostrou que os pacientes estaban significativamente deteriorados na detección de estímulos táctiles sinxelos e na proba de identificación de texturas de forma 1.5 anos despois da cirurxía (Taylor et al., 2008a). Esta última proba avalía a capacidade dun paciente para recoñecer as características dun obxecto mentres explora activamente unha forma ou textura, requirindo a integración de información sensorial a través de rexións do corpo (Rosen e Lundborg, 1998). En conxunto, unha interpretación dos nosos datos é que os pacientes con PNIr atenden máis ao estímulo vibrotáctil, o que leva a unha maior activación da rede positiva de tarefas e BA1 / 3. Non obstante, nestes pacientes, os nosos datos implican que as áreas de procesamento de orde superior, como BA2 e S2, non recibiron información táctil, o que, á súa vez, pode provocar un adelgazamento cortical e unha resposta BOLD reducida.
BA2 e S2 reciben proxeccións de BA1 / 3b e tamén de distintas partes do complexo talámico ventroposterior (Pons et al., 1985; Friedman e Murray, 1986). Ambos cerebro as áreas teñen campos receptivos grandes, a miúdo de varios díxitos (BA2) ou bilaterais (S2) (Pons et al., 1985; Iwamura et al., 2002). Baseado en proxeccións anatómicas e propiedades de resposta neuronal, demostrouse o procesamento xerárquico da información táctil desde BA1 / 3b ata BA 2 (Kaas et al., 2002). Ademais, estudos electrofisiolóxicos en macacos (Pons et al., 1987) e datos de magnetoencefalografía adquiridos en humanos, suxiren que o procesamento en serie de entradas táctiles ocorre de S1 a S2 en primates superiores (Frot e Mauguiere 1999; Disbrow et al. ., 2001). Varios estudos demostraron que o BA2 está preferentemente activado pola forma e a curvatura (Bodegard et al., 2001), mentres que o S2 pode estar implicado na aprendizaxe táctil (Ridley e Ettlinger 1976; Murray e Mishkin, 1984), apoiando a noción de que estas áreas cerebrais están implicados no procesamento somatosensorial de orde superior. A nosa avaliación psicofísica demostrou que os pacientes estaban significativamente deteriorados na detección de estímulos táctiles sinxelos e na proba de identificación de texturas de forma 1.5 anos despois da cirurxía (Taylor et al., 2008a). Esta última proba avalía a capacidade dun paciente para recoñecer as características dun obxecto mentres explora activamente unha forma ou textura, requirindo a integración de información sensorial a través de rexións do corpo (Rosen e Lundborg, 1998). En conxunto, unha interpretación dos nosos datos é que os pacientes con PNIr atenden máis ao estímulo vibrotáctil, o que leva a unha maior activación da rede positiva de tarefas e BA1 / 3. Non obstante, nestes pacientes, os nosos datos implican que as áreas de procesamento de orde superior, como BA2 e S2, non recibiron información táctil, o que, á súa vez, pode provocar un adelgazamento cortical e unha resposta BOLD reducida.
A insula pénsase que desempeña un papel na integración de información multimodal importante para as funcións sensorimotoras, emocionales, alostáticas / homeostáticas e cognitivas (Devinsky et al., 1995; Critchley, 2004; Craig, 2008) e foi designada como cortiza sensorial límbica (Craig , 2008). Varios estudos informaron de activación insular en resposta á estimulación táctil (Gelnar et al., 1998;
Downar et al., 2002) e estudos de rastreo anatómico nos primates demostraron que a insula está unida recíprocamente aos lóbulos frontal, parietal e temporal (Augustine, 1996). Nos nosos pacientes, a insula anterior dereita foi a única área cortical que demostrou un adelgazamento cortical significativo xunto con valores reducidos de anisotropía fraccionada na materia branca adxacente, o que suxire que o adelgazamento cortical dentro desta rexión está asociado cunha perda de fibras que se proxectan desde ou esta estrutura. A insula anterior dereita foi implicada na interoceción xa que está situada para integrar a entrada homeostática do corpo con condicións motivacionais, emocionais e sociais (Craig, 2008). Ademais, Critchley et al. (2004) informou dunha correlación entre as habilidades interoceptivas eo volume da materia gris da insula anterior dereita. Dado o noso descubrimento de que os pacientes diminuíron a materia gris na parte superior dereita anterior, sería de interese evaluar as capacidades interoceptivas despois da lesión do nervio periférico nun estudo futuro.
Tomados en conxunto, demostramos por primeira vez que as alteracións funcionais e estruturais están presentes na corteza cerebral humana 1.5 anos logo dunha transición completa dun nervio periférico do extremo superior que foi reparado microsecoricamente. Ademais, as medidas de condución nerviosa indican unha regeneración periférica incompleta nestes pacientes. Ademais, demostramos que o espesor cortical está relacionado coas medidas psicofísicas de recuperación, na que o delgado corte dentro de BA2 e S2 asociouse cunha función somatosensorial máis baixa. Estes datos suxiren que o restablecemento dos mapas de activación funcionais normais está directamente asociado coa rexeneración exitoso de aferentes periféricos.
Keri S. Taylor, 1,2 Dimitri J. Anastakis2,3,4 e Karen D. Davis1,2,3
1 División de Cerebro, Imaxe e Comportamento - Neurociencia de Sistemas, Toronto Western Research Institute, University Health Network, Toronto, Canadá M5T258
2 Instituto de Ciencias Médicas da Universidade de Toronto, Canadá
3 Departamento de Cirurxía da Universidade de Toronto, Canadá
4 Centro de Recursos de Estudos Clínicos, Toronto Western Research Institute, University Health Network, Toronto, Canadá M5T2S8
Correspondencia con: Karen D. Davis, Ph.D.,
División de cerebro, imaxe e comportamento - Neurociencia de sistemas, Toronto Western Research Institute,
Toronto Western Hospital,
Rede sanitaria universitaria,
Sala MP14-306, 399 Bathurst Street,
Toronto, Ontario,
Canadá M5T 2S8
E-mail: kdavis@uhnres.utoronto.ca
Grazas
Os autores agradecen ao señor Geoff Pope, o doutor Adrian Crawley, o señor Eugene Hlasny eo señor Keith Ta por asistencia técnica experta. Os autores queren agradecer ao Dr Peter Ashby e ao Sr Freddy Paiz da Clínica EMG do Hospital Western Toronto para levar a cabo as probas de condución nerviosa e proporcionar unha avaliación pericial dos resultados. Os autores tamén agradecen aos Drs. Dvali, Binhammer, Fialkov e Antonyshyn por colaborar con este proxecto. O Dr. Davis é unha Catedra de Investigación de Canadá en Cerebro e Comportamento (CIHR MOP 53304).
Financiamento
The Physicians Services Incorporated e unha bolsa conxunta de sementes do University of Toronto Center for the Study of Pain / AstraZeneca.
Material complementario
O material complementario está dispoñible en Brain en liña.
en branco
Referencias:
Apkarian AV, Sosa Y, Sonty S, et al. A dor lumbar crónica está asociada a
diminución da densidade de materia gris prefrontal e talámica. J Neurosci
2004; 24: 10410-5.
Arthurs OJ, Johansen-Berg H, Matthews PM, Boniface SJ. Atención
modula diferencialmente o acoplamento de fMRI BOLD e evoca
amplitudes do sinal potencial na cortiza somatosensorial humana 7.
Exp Brain Res 2004; 157: 269 74.
Agustín JR. Circuítos e aspectos funcionais do lóbulo insular
en primates incluídos os humanos. Brain Res Brain Res Rev 1996; 22:
229 44.
Beaulieu C. A base da difusión de auga anisotrópica no nervioso
sistema: unha revisión técnica. RMN Biomed 2002; 15: 435-55.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Xerárquico
procesamento da forma táctil no cerebro humano. Neuron 2001; 31:
317 28.
Craig AD. Interocepción e emoción: unha perspectiva neuroanatómica.
En: Lewis M, Haviland-Jones J, Barrett L, editores. Manual de
emocións. Nova York: Guildford Press; 2008. páx. 272 87.
Critchley HD. A cortiza humana responde a un desafío interoceptivo.
Proc Natl Acad Sci USA 2004; 101: 6333 4.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Sistemas neuronais
apoiando a conciencia interoceptiva. Nat Neurosci 2004; 7: 189-95.
Dale AM, Fischl B, Sereno MI. Análise baseada en superficie cortical. I. Segmentación
e reconstrución superficial. Neuroimaxe 1999; 9: 179 94.
Davis KD, Pope G, Chen J, Kwan CL, Crawley AP, Diamant NE. Cortical
adelgazamento no SII: implicacións para homeostática, atención e dor
procesamento. Neuroloxía 2008; 70: 153-4.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI en repouso
as redes estatais definen modos distintos de interaccións a longa distancia
no cerebro humano. Neuroimaxe 2006; 29: 1359 67.
Devinsky O, Morrell MJ, Vogt BA. Contribucións do cingulado anterior
cortiza ao comportamento. Cerebro 1995; 118 (Pt 1): 279-306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Evidencia para o interhemisférico
procesamento de entradas das mans en S2 humano
e PV. J Neurofisiol 2001; 85: 2236 44.
Downar J, Crawley AP, Mikulis DJ, Davis KD. Unha rede cortical sensible
para estimular a atención nun contexto de comportamento neutro entre múltiples
modalidades sensoriais. J Neurofisioloxía 2002; 87: 615 20.
Draganski B, Moser T, Lummel N, et al. Diminución do gris talámico
materia tras a amputación das extremidades. Neuroimaxe 2006; 31: 951-7.
Fischl B, Dale AM. Medición do espesor da cortiza cerebral humana
a partir de imaxes de resonancia magnética. Proc Natl Acad Sci USA 2000; 97:
11050 5.
Fischl B, Sereno MI, Dale AM. Análise baseada en superficie cortical. II:
Inflación, aplanamento e un sistema de coordenadas baseado na superficie.
Neuroimaxe 1999a; 9: 195 207.
Fischl B, Sereno MI, Tootell RB, Dale AM. Intersubxecto de alta resolución
media e un sistema de coordenadas para a superficie cortical. Hum Brain
Mapp 1999b; 8: 272 84.
Florence SL, Kaas JH. Reorganización a grande escala en múltiples niveis do
a vía somatosensorial segue a amputación terapéutica da man
en monos. J Neurosci 1995; 15: 8083 95.
Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. O
o cerebro humano está intrínsecamente organizado en dinámico, anticorrelacionado
redes funcionais. Proc Natl Acad Sci USA 2005; 102: 9673-9678.
Friedman DP, Murray EA. Conectividade talámica do segundo
área somatosensorial e campos somatosensoriais veciños do
sulco lateral do macaco. J Comp Neurol 1986; 252: 348 73.
Frot M, Mauguiere F. Temporalización e distribución espacial do somatosensorial
respostas rexistradas no banco superior da fisura silviana (área SII) en
humanos. Cereb Cortex 1999; 9: 854 63.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
O cerebro na dor crónica de CRPS: substancia gris-branca anormal
interaccións en rexións emocionais e autonómicas. Neuron 2008; 60:
570 81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Representación da punta dos dedos
no córtex somatosensorial humano: un estudo de resonancia magnética.
Neuroimaxe 1998; 7: 261-83.
Hickmott PW, Steen PA. Cambios a gran escala na estrutura dendrítica
durante a reorganización da cortiza somatosensorial dos adultos. Nat Neurosci
2005; 8: 140-42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Procesamento de
sinais táctiles e cinestésicos dende os lados bilaterais do corpo no
xiro postcentral de monos espertos. Behav Brain Res 2002; 135:
185 90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Lesións medianas, cubitales e combinadas do nervio cubital: funcionais
resultado e retorno á produtividade. J Trauma 2001; 51: 687 92.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Atrofia corticosomatosensorial despois da lesión da medula espiñal: baseada no voxel
estudo da morfometría. Neuroloxía 2006; 66: 762 4.
Kaas JH. Plasticidade dos mapas sensoriais e motores en mamíferos adultos. Annu
Rev Neurosci 1991; 14: 137-67.
Kaas JH, Jain N, Qi HX. A organización do sistema somatosensorial en
primates. En: Nelson RJ, editor. O sistema somatosensorial.
Washington, DC: CRC Press; 2002. páx. 1 25.
Kimura J. Electrodiagnóstico en enfermidades do nervio e do músculo: principios
e práctica. Oxford: Oxford University Press; 2001.
Kimura J. Principios e trampas dos estudos de condución nerviosa. Ann Neurol
1984; 16: 415-29.
Knyihar-Csillik E, Rakic P, Csillik B. Dexeneración transneuronal en
a substancia Rolando da medula espinal do primate evocada por
atrofia dexenerativa transganglionaria inducida pola axotomía de central
terminais sensoriais primarios. Cell Tissue Res 1989; 258: 515 25.
Liss AG, de Ekenstam FW, Wiberg M. Perda de neuronas na raíz dorsal
ganglios despois da transección dun nervio sensorial periférico. Un anatómico
estudo en monos. Scand J Plast Reconstr Surg Surg Hand Surg 1996; 30: 1-6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Movementos fantasma
e dor. Un estudo por resonancia magnética en amputados dos membros superiores. Cerebro 2001;
124: 2268 77.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Serie
Resonancia magnética dos cambios adaptativos na córtex sensoriomotora primaria
reconstrución do polgar. Neuroloxía 2002; 59: 1278-81.
Maio A. A dor crónica pode cambiar a estrutura do cerebro. Dor 2008;
137: 7 15.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. A epidemioloxía e
xestión das lesións do nervio periférico do membro superior en modernas
práctica. J Hand Surg (Br) 1996; 21: 4-13.
Murray EA, Mishkin M. Contribucións relativas de SII e area5 ao tacto
discriminación en monos 2. Behav Brain Res 1984; 11: 67–83.
Napadow V, Kettner N, Ryan A, Kwong KK, Audette J, Hui KK.
Plasticidade somatosensorial cortical na síndrome do túnel do carpo: unha sección transversal
Avaliación fMRI. Neuroimaxe 2006; 31: 520-30.
Oldfield RC. A avaliación e análise da man: o Edimburgo
inventario. Neuropsicoloxía 1971; 9: 97.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. A organización somatotópica
da área 2 en monos macacos 6. J Comp Neurol 1985; 241: 445 ́66.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Evidencia fisiolóxica
para o procesamento en serie na cortiza somatosensorial. Ciencia 1987; 237:
417 20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Actividade relacionada coa percepción
no sistema somatosensorial humano: resonancia magnética funcional
estudos de imaxe. Imaxe Reson Magn 2004; 22: 1539 48.
Powell TP, Erulkar S. Dexeneración celular transneuronal no auditorio
núcleos de retransmisión do gato. J Anat 1962; 96: 249 68.
Ridley RM, Ettlinger G. Deterioro da aprendizaxe e retención táctil despois
eliminacións da segunda cortiza de proxección sensorial somática (SII) no
mono. Brain Res 1976; 109: 656 60.
Rosen B, Lundborg G. Un novo instrumento de gnose táctil na sensibilidade
probando. J Hand Ther 1998; 11: 251-7.
Seminowicz DA, Davis KD. A dor mellora a conectividade funcional
dunha rede cerebral evocada pola realización dunha tarefa cognitiva.
J Neurofisiol 2007; 97: 3651-9.
Smith SM, Jenkinson M, Johansen-Berg H, et al. Espacial baseado en vías
estatísticas: análise voxelwise de datos de difusión multi-tema.
Neuroimaxe 2006; 31: 1487-1505.
Talairach J, Tournoux P. Atlas estereotáxico coplanar do cerebro humano.
Nova York: Thieme Medical Publishers Inc .; 1988.
Taylor KS, Anastakis DJ, Davis KD. Dor crónica despois do periférico
a lesión nerviosa está asociada a unha catastrófica dor e neurotismo.
Int Ass Stud Pain 2008a; 267.
Taylor KS, Davis KD. Estabilidade da resonancia magnética táctil e coa dor
activacións cerebrais: un exame de limiar dependente e
métodos independentes do limiar. Hum Brain Mapp 2009; 30:
1947 62.
Taylor KS, Seminowicz DA, Davis KD. Dous sistemas de estado de repouso
conectividade entre a insula e a cortiza cingulada. Hum Brain
Mapp 2008b; DOI: 10.1002 / hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, DJ Felleman, Merzenich MM.
Reorganización funcional nas áreas corticais somatosensoriais 3b e 1
de monos adultos despois da reparación do nervio mediano: posible relación coa
recuperación sensorial en humanos. J Neurosci 1986; 6: 218-33.
Acordo pechado
Ámbito de práctica profesional *
A información aquí contenida en "Cortar os nervios Cambia o cerebro | El Paso, TX." non pretende substituír unha relación individual cun profesional da saúde cualificado ou un médico licenciado e non é un consello médico. Animámoslle a que tome decisións sobre a saúde baseándose na súa investigación e colaboración cun profesional sanitario cualificado.
Información do blog e debates de alcance
O noso ámbito de información limítase a quiropráctica, músculo-esqueléticos, medicamentos físicos, benestar, contribuíndo etiolóxico trastornos viscerosomáticos dentro de presentacións clínicas, dinámica clínica do reflexo somatovisceral asociado, complexos de subluxación, problemas de saúde sensibles e/ou artigos, temas e discusións de medicina funcional.
Proporcionamos e presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista réxese polo seu ámbito profesional e a súa xurisdición de licenza. Usamos protocolos funcionais de saúde e benestar para tratar e apoiar a atención das lesións ou trastornos do sistema músculo-esquelético.
Os nosos vídeos, publicacións, temas, temas e coñecementos abarcan asuntos clínicos, cuestións e temas relacionados co noso ámbito de práctica clínica e apoian directa ou indirectamente o noso ámbito de práctica.*
A nosa oficina intentou razoablemente proporcionar citas de apoio e identificou o estudo ou estudos de investigación relevantes que apoian as nosas publicacións. Proporcionamos copias dos estudos de investigación de apoio dispoñibles para os consellos reguladores e o público logo de solicitude.
Entendemos que cubrimos asuntos que requiren unha explicación adicional de como pode axudar nun determinado plan de atención ou protocolo de tratamento; polo tanto, para debater máis sobre o tema anterior, non dubide en preguntar Dr. Alex Jiménez, DC, ou póñase en contacto connosco 915-850-0900.
Estamos aquí para axudarche a ti e á túa familia.
Bendicións
Dr. Alex Jiménez ANUNCIO, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenciado como Doutor en Quiropráctica (DC) en Texas & Novo México*
Número de licenza de Texas DC TX5807, New Mexico DC Número de licenza NM-DC2182
Licenciada como enfermeira rexistrada (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (Nº de control 3558029)
Estado compacto: Licenza multiestatal: Autorizado para Practicar en Estados 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
A miña tarxeta de visita dixital