1. QUEN. QUEN | Sobrepeso e obesidade. www.who.int/gho/ncd/
risk_factors / overweight / en / index.html. Accedeu a 29 2015 de xaneiro.
2. Visscher PM, MA de Brown, McCarthy MI, Yang J. Cinco anos de descubrimento de GWAS.
Son J Hum Genet. 2012;90:7�24.
3. Locke AE, Kahali B, Berndt SI, Xustiza AE, Pers TH, Día FR, et al. Xenética
Os estudos do índice de masa corporal dan novas ideas para a bioloxía da obesidade. Natureza.
2015; 518: 197-206.
4. Ling C, Del Guerra S, Lupi R, R�nn T, Granhall C, Luthman H, et al.
Regulación epigenética de PPARGC1A en islotes diabéticos 2 de tipo humano e
efecto sobre a secreción de insulina. Diabetoloxía. 2008;51:615-22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. Epigenética
e a obesidade humana. Int J Obes (Londres). 2015;39:85-97.
6. O AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, et al. O efecto de
xenotipo e ambiente in utero sobre variación interindividual no recén nacido
ADN metilomas. Res. do xenoma 2014;24:1064-74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA, et al. Genomewide
asociacións entre influencia de variación xenética e epixenética
expresión do ARNm e secreción de insulina nos illotes pancreáticos humanos. PLoS
Genet. 2014; 10: e1004735.
8. Grundberg E, Meduri E, Sandling JK, AK Hedman, Keildson S, Buil A, et al.
Análise global da variación de metilación do ADN no tecido adiposo dos xemelgos
revela ligazóns a variantes asociadas a enfermidades en elementos reguladores distales.
Son J Hum Genet. 2013;93:876�90.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Impacto dos niveis de idade, IMC e HbA1c no ADN de todo o xenoma
patróns de expresión de metilación e ARNm no tecido adiposo humano
e identificación de biomarcadores epixenéticos en sangue. Hum Mol Genet.
2015; 24: 3792-813.
10. Waterland RA, Michels KB. Epidemioloxía epigenética do desenvolvemento
hipótese das orixes. Annu Rev Nutr. 2007;27:363-88.
11. McMillen IC, Rattanatray L, JA Duffield, Morrison JL, MacLaughlin SM, Gentili
S, et al. As orixes tempranas da obesidade posterior: vías e mecanismos. Adv
Exp Med Biol. 2009;646:71-81.
12. Ravelli A, van der Meulen J, Michels R, Osmond C, Barker D, Hales C, et al.
Tolerancia á glicosa en adultos tras a exposición prenatal á fame. Lancet.
1998; 351: 173-7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. As orixes do desenvolvemento da enfermidade ea saúde dos adultos: o papel
nutrición periconcepcional e fetal. Clin Base Farmacol Toxicol.
2008; 102: 82-9.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. Periconceptional
nutrición e programación precoz dunha vida de obesidade ou adversidade. Prog
Biophys Mol Biol. 2011;106:307-14.
15. Bouret S, Levin BE, Ozanne SE. Control de interaccións xeo-ambiente
homeostase de enerxía e glicosa e as orixes do desenvolvemento da obesidade.
Physiol Rev. 2015;95:47�82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, et al.
A obesidade materna aumenta a diferenciación do tecido adiposo branco e altera
metilación do ADN a escala do xenoma en descendentes de rato macho. Endocrinoloxía.
2013; 154: 4113-25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
et al. A plasticidade metabólica durante o desenvolvemento de mamíferos é direccional
dependente do estado nutricional precoz. Proc Natl Acad Sci US A.
2007; 104: 12796-800.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
et al. A metilación do promotor do xene epigenético está asociada ao nacemento
adiposidade posterior do neno. Diabetes. 2011;60:1528-34.
19. McMillen IC, Adam CL, Muhlhausler BS. Orixes tempranas da obesidade:
programación do sistema regulador do apetito. J Physiol. 2005;565(Pt 1):9.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F, et al.
Os cambios epigenéticos nas vías reguladoras da enerxía hipotalámica son
asociado coa desnutrición materna e o irmandamento. FASEB J.
2012; 26: 1694-703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, et al. Obesidade materna
ea diabetes pode causar alteración da metilación do ADN nos espermatozoides de
descendentes nos ratos. Reprod Biol Endocrinol. 2014; 12: 29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, et al.
A desnutrición perinatal afecta á metilación e á expresión da leptina
xene en adultos: implicación na comprensión da síndrome metabólica.
FASEB J. 2011;25:3271�8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
A dieta materna durante o embarazo induce a expresión xénica e o ADN
cambios de metilación nos tecidos fetais nas ovellas. Front Genet. 2013; 4: 49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, et al.
A obesidade e diabetes materna inducen defectos metabólicos latentes e
cambios epixenéticos xeneralizados en ratos isoxénicos. Epixenética. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Proteína dietética
A restrición das ratas embarazadas induce e suplementación de ácido fólico impide
modificación epixenética da expresión do xene hepático na descendencia. J Nutr.
2005; 135: 1382-6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, et al. Utero
efectos. A desnutrición inúrica perturba o espermatozoide metiloma
e metabolismo intergeneracional. Ciencia. 2014; 345 (80): 1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, et al.
Epigenómica: a exposición materna a graxa elevada en graxas interrompe
expresión dos xenes circadianos periféricos en primates non humanos. FASEB J.
2011; 25: 714-26.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA, et al. Utero
a exposición a unha dieta alta en graxas materna modifica o código epigenético da histona a
modelo murino. Am J Obs Gynecol. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, et al.
Epigenética da obesidade programada: alteración na IUFG IGF1 de ratas
expresión do ARNm e estrutura das histonas en postnatal rápido ou retardado
crecemento de recuperación. Am F Physiol Gastrointest Physiol.
2010;299:G1023�9.
30. Sandovici I, Smith NH, MD Nitert, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
et al. A dieta materna e o envellecemento alteran o control epigenético dun promoter
interacción co xene Hnf4a en illotes pancreáticos de ratos. Proc Natl
Acad Sci US A. 2011;108:5449�54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Investigations on
Resposta epixenética transxeneracional baixo a liña masculina en porcos F2. PLoS
Un. 2012; 7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, et al. Paternalmente
reprogramación ambiental transgeneracional inducida de metabolismo
expresión xénica en mamíferos. Célula. 2010;143:1084-96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. Dieta paterna
define o estado da cromatina dos fillos e a obesidade interxeracional. Cela.
2014; 159: 1352-64.
34. Martínez D, Pentinat T, Rib S, Daviaud C, Bloks VW, Cebri� J, et al. No útero
a desnutrición en ratones macho programa o metabolismo lipídico hepático na segunda xeración
descendencia que implica metilación modificada do ADN de Lxra. Cell Metab.
2014; 19: 941-51.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H, et al. Paternalmente
herdanza transxeneracional inducida de susceptibilidade á diabetes en
mamíferos. Proc Natl Acad Sci US A. 2014;111:1873�8.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. herdanza epixenética transxeneracional: ¿como é importante? Nat Rev
Genet. 2013;14:228-35.
37. Pembrey M, Saffery R, Bygren LO. Respostas transxeneracionais humanas a
Experiencia de vida cedo: potencial impacto no desenvolvemento, saúde e
investigación biomédica. J Med Genet. 2014;51:563-72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Epigenética materna e metilo
os suplementos afectan á expresión dos xenes agutí en ratos Avy / a. FASEB J.
1998; 12: 949-57.
39. Jirtle RL, Skinner MK. Epigenómica ambiental e susceptibilidade á enfermidade.
Nat Rev Genet. 2007;8:253-62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Herdanza epigenética en
o locus agouti no rato. Nat Genet. 1999;23:314-8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Liña xermánica epigenética
modificación do alelo murino A vy por suplementos nutricionais. Proc
Natl Acad Sci US A. 2006;103:17308�12.
42. Hoile SP, Lillycrop KA, Thomas NA, MA de Hanson, GC Burdge. Proteína dietética
A restricción durante o embarazo F0 nos ratos induce cambios transgeneracionais en
o transcriptoma hepático en descendencia feminina. PLoS One. 2011; 6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, et al. Mousehuman
A análise epixenética experimental desemboca os obxectivos dietéticos e
responsabilidade xenética para fenotipos diabéticos. Metab celular. 2015;21:138�49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, et al.
Recomendacións para o deseño e análise de todo o epixenoma
estudos de asociación. Métodos Nat. 2013;10:949-55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R�nn T, Ling C. Identificación de
CpG-SNPs asociados coa diabetes tipo 2 e a metilación diferencial do ADN
nos illotes pancreáticos humanos. Diabetoloxía. 2013;56:1036�46.
46. Relton CL, Davey Smith G. Aleatorización epigenética Mendeliana en dous pasos: a
estratexia para establecer o papel causal dos procesos epixenéticos nas vías
á enfermidade. Int J Epidemiol. 2012;41:161-76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
Os datos de asociación en todo o epigenoma implican a metilación do ADN
intermediario de risco xenético na artrite reumatoide. Nat Biotechnol.
2013; 31: 142-7.
48. Yuan W, Xia Y, Bell CG, pero eu, Ferreira T, Ward KJ, et al. Un sistema integrado
análise epigenómica para os tipos de susceptibilidade á diabetes tipo 2 en monocigóticos
xemelgos. Nat Commun. 2014; 5: 5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, et al. Impacto dun
exercitar a intervención sobre a metilación do ADN no músculo esquelético desde o primeiro grado
familiares de pacientes con diabetes tipo 2. Diabetes. 2012;61:3322�32.
50. Gagnon F, Assi D, Carrie A, Morange PE, Tr�gou�t DA. Validación sólida de
asociación de niveis de metilación no lugar do CPT1A con niveis plasmáticos de lípidos.
J Lipid Res. 2014;55:1189-91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
et al. Asociación de asociacións de epigenoma amplo (EWAS) de IMC, cambio de IMC e
A circunferencia da cintura en adultos afroamericanos identifica múltiples repetidos
loci. Hum Mol Genet. 2015: ddv161�.
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, Assi D, Wahl S, et al. ADN
metilación e índice de masa corporal: unha análise do xenoma. Lancet.
2014; 6736: 1-9.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G, et al. Metilación do ADN
o xene LY86 está asociado coa obesidade, resistencia á insulina e
inflamación. Twin Res Hum Genet. 2014;17:183-91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, et al.
PGC1? a metilación do promotor no sangue aos 5-7 anos predice a adiposidade de
9 a 14 anos (EarlyBird 50). Diabetes. 2014;63:2528�37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, et al.
ADRB3 xene promotor metilación do ADN en sangue e visceral
o tecido está asociado con trastornos metabólicos nos homes. Epigenómica.
2014; 6: 33-43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. A preposidade é
asociado co perfil de metilación do ADN no tecido adiposo. Int J Epidemiol.
2014: 1-11.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, et al.
Estudo da asociación en todo o epigenoma dos lípidos no sangue en xaxún na xenética de
Estudo da rede de medicamentos hipolipemiantes e dieta. Circulación. 2014;130:565-72.
58. Frazier-Wood AC, Aslibekyan S, DM Absher, Hopkins PN, Sha J, Tsai MY, et al.
A metilación no locus CPT1A está asociada coa subfracción de lipoproteínas
perfís. J Lipid Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, LC Pilling, Reischl E, JK Sandling, Kunze S, et al. ADN
a metilación dos xenes relacionados cos lípidos afecta aos niveis de lípidos na sangue. Circ Cardiovasc
Genet. 2015.
60. Petersen AK, Zeilinger S, Kastenmöller G, Römisch-Margl W, Brugger M, Peters
A, et al. A epigenética coñece a metabolómica: unha asociación de todo o epigenoma
estudo dos trazos metabólicos do soro sanguíneo. Hum Mol Genet. 2014;23:534-45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, et al. Epigenomewide
estudo da asociación de medidas de xaxún en glicosa, insulina e HOMA-IR
no estudo da xenética dos medicamentos para reducir os lípidos e da rede de dieta. Diabetes.
2014; 63: 801-7.
62. Dayeh T, Volkov P, Sal� S, Hall E, Nilsson E, Olsson AH, et al. Todo o xenoma
Análise de metilación do ADN de illotes pancreáticos humanos do tipo diabético 2
e os doadores non diabéticos identifican xenes candidatos que inflúen na insulina
secreción. PLoS Genet. 2014; 10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, et al.
Alteración da metilación do ADN e expresión diferencial de xenes que inflúen
metabolismo e inflamación no tecido adiposo de individuos con tipo 2
diabetes. Diabetes. 2014;63:2962-76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, et al. Unha análise da metilación do ADN no tecido adiposo humano revela modificacións diferenciais dos xenes da obesidade antes e despois do desvío e peso gástrico
perda. Xene. 2015;16:1�21.
65. Bateson P, Gluckman P. Plasticidade e robustez no desenvolvemento e
evolución. Int J Epidemiol. 2012;41:219-23.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evolución da saúde e
medicina Coloquio de Sackler: variación epixenética estocástica como condución
forza de desenvolvemento, adaptación evolutiva e enfermidade. Proc Natl Acad
Sci US A. 2010;107(Suppl):1757-64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, MN de Cruickshank, Saffery R, et al.
Análise lonxitudinal en escala do xenoma da metilación do ADN en xemelgos desde o nacemento
a 18 meses de idade revela un rápido cambio epixenético nos primeiros anos da vida e no especifico de parellas
efectos da discordancia. Xenoma Biol. 2013; 14: R42.
68. Tobi EW, JJ Goeman, Monajemi R, Gu H, Putter H, Zhang Y, et al. ADN
as sinaturas de metilación ligan a exposición prenatal ao crecemento e fame
metabolismo. Nat Commun. 2014; 5: 5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, et al.
A nutrición materna na concepción modula a metilación do ADN humano
epiteleles metasables. Nat Commun. 2014; 5: 3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, et al.
Impacto nos patróns de metilación dos fillos da diabetes gestacional materna
A moderación do crecemento mellitus e intrauterino suxire xenes comúns e
vías relacionadas co risco posterior de diabetes tipo 2. FASEB J. 2014: 1�12.
71. Morales E, Groom A, Lawlor DA, Relton CL. Sinaturas de metilación do ADN en
sangue do cordón umbilical asociado á ganancia de peso gestacional materno: resultados de
a cohorte ALSPAC. BMC Res Notes. 2014; 7: 278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, et al.
A diabetes mellitus gestacional afecta epigenética xenes predominantemente
implicados en enfermidades metabólicas. Epixenética. 2013;8:935�43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y, et al. Materna
Índice de masa corporal previa á concepción e ADN do sangue de cordo descendente
metilación: exploración das orixes iniciais da enfermidade. Environ Mol
Mutáxeno. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF, et al.
Os recentemente nados de pais obesos alteraron os patróns de metilación do ADN en
xenes impresos. Int J Obes (Londres). 2015;39:650�7.
75. Jacobsen SC, Br�ns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
Efectos da alimentación excesiva de graxas a longo prazo no ADN de todo o xenoma
metilación no músculo esquelético de homes novos e sans. Diabetologia.
2012; 55: 3341-9.
76. Gillberg L, Jacobsen SC, R�nn T, Br�ns C, Vaag A. PPARGC1A DNA
metilación no tecido adiposo subcutáneo en suxeitos de baixo peso ao nacer
impacto de 5 días de sobrealimentación rica en graxas. Metabolismo. 2014;63:263-71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Patróns epixenéticos nos mantedores de perda de peso exitosos: un estudo piloto. Int J
Obes (Londres). 2015;39:865�8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N�slund E,
Zierath JR. Perda de peso tras a cirurxía de bypass gástrico na obesidade humana
remodela a metilación do promotor. Rep. celular 2013: 1�8.
79. Ahrens M, Ammerpohl O, von Sch�nfels W, Kolarova J, Bens S, Itzel T, et al.
Análise de metilación do ADN en enfermidades de fígado graxo non alcohólico
distintas sinaturas de enfermidade e remodelación despois da cirurxía bariátrica.
Metab celular. 2013;18:296-302.
80. Voisin S, Eynon N, Yan X, Bispo DJ. Exercita o adestramento e metilación do ADN
en humanos. Acta Physiol (Oxf). 2014;213:39-59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Eksstr�m TJ,
Tegnér J, et al. Unha análise integradora revela unha reprogramación coordinada
Despois do epixenoma e do transcriptoma no músculo esquelético humano
formación. Epixenética. 2014;9:1557-69.
82. Denham J, O Brien BJ, Marques FZ, Charchar FJ. Cambios no leucocito
o metiloma eo seu efecto nos xenes cardiovasculares despois do exercicio.
J Appl Physiol. 2014: jap.00878.2014.
83. Rowlands DS, Page RA, WR Sukala, Giri M, SD de Ghimbovschi, Hayat I, et al.
As redes integradas multiomáticas conectan a metilación do ADN eo miRNA
plasticidade do músculo esquelético ao exercicio crónico da obesidade diabética tipo 2.
Physiol Genomics. 2014;46:747-65.
84. Horvath S, Erhart W, Brosch M, Ammerpohl Ou, von Schonfels W, Ahrens M,
et al. A obesidade acelera o envellecemento epigenético do fígado humano. Proc Natl Acad
Sci. 2014;111:15538�43.
85. Alm�n MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
A análise de todo o xenoma revela marcadores de metilación do ADN que varían segundo
tanto a idade como a obesidade. Xene. 2014.;548:61�7
86. Houseman EA, Molitor J, Marsit CJ. Axustes de mestura de células libres de referencia
na análise de datos de metilación do ADN. Bioinformática. 2014;30:1431�9.
87. Wells JC. Unha valoración crítica da hipótese de resposta adaptativa predictiva.
Int J Epidemiol. 2012;41:229-35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, et al. Número de embrións e desnutrición periconcepcional na
as ovellas teñen efectos diferenciales no epigenotipo adrenal, no crecemento e
desenvolvemento. Am J Physiol Endocrinol Metab. 2014;307:E141�50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
Obesidade materna e orixes tempranas da obesidade infantil: levantamento
os beneficios e os custos da perda de peso materna no periconcepcional
período para a descendencia. Exp Diabetes Res. 2011; 2011: 585749.
90. Zhang S, Williams-Wyss Ou, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, et al. Desnutrición materna durante a primeira semana despois da concepción
resulta na diminución da expresión do ARNm do receptor de glucocorticoides na
ausencia de GR exón Xermes 17 na hipófise fetal a finais
xestación. J Dev Orig Heal Dis. 2013;4:391�401.
91. Lie S, Morrison JL, Williams-Wyss Ou, Suter CM, Humphreys DT, Ozanne SE,
et al. Os programas de desnutrición periconcepcional cambian na sinalización da insulina
moléculas e microRNAs no músculo esquelético en singleton e xemelgo fetal
ovellas. Biol Reprod. 2014; 90: 5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ, et al. A activación do receptor x de fígado fetal induce agudamente a lipogênese pero
non afecta á resposta lipídica no plasma a unha dieta rica en graxas nos ratos adultos. Am J
Physiol Endocrinol Metab. 2009;297:E1171�8.
93. Fernandez-Twinn DS, Alfaradhi MZ, MS Martin-Gronert, Duque-Guimarães
DE, Piekarz A, Ferland-McCollough D, et al. Baixa regulación de IRS-1 en
O tecido adiposo da descendencia de ratos obesos está programado de xeito cellautonomo
a través de mecanismos post-transcricionais. Mol Metab.
2014; 3: 325-33.
94. Waterland RA, Travisano M, Tahiliani KG. Hipermetilación inducida pola dieta en
o agutí viable amarelo non se herda transgeneracionalmente a través da femia.
FASEB J. 2007;21:3380�5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, et al. Metilación do ADN en
os ovocitos e o fígado das ratas femininas e os seus descendentes: efectos da dieta alimentaria con alto contido de graxa
obesidade. Env Heal Perspect. 2014;122:159-64.
96. Ollikainen M, Ismail K, Gervin K, Kyllnen A, Hakkarainen A, Lundbom J, et al.
Alteracións da metilación do ADN sanguíneo en todo o xenoma nos elementos reguladores
e rexións heterocromáticas nos xemelgos monocigóticos discordantes para a obesidade
e graxa do fígado. Clin Epigenética. 2015; 7:1-13.




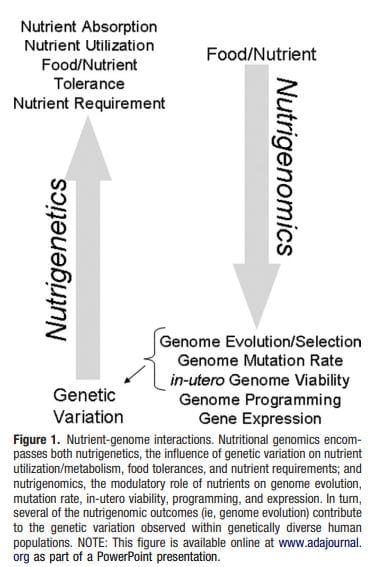




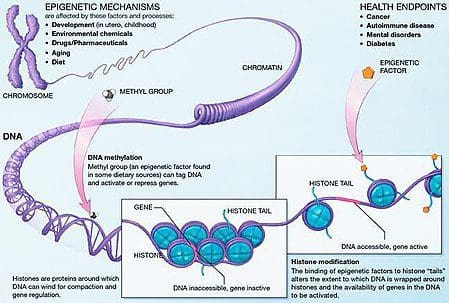 A obesidade é unha enfermidade complexa e multifactorial e unha mellor comprensión dos mecanismos subxacentes ás interaccións entre estilo de vida, medio ambiente e xenética é fundamental para o desenvolvemento de estratexias eficaces para a prevención e o tratamento [1].
A obesidade é unha enfermidade complexa e multifactorial e unha mellor comprensión dos mecanismos subxacentes ás interaccións entre estilo de vida, medio ambiente e xenética é fundamental para o desenvolvemento de estratexias eficaces para a prevención e o tratamento [1]. Os modelos animais ofrecen oportunidades únicas para estudos altamente controlados que proporcionan unha visión mecanicista do papel de marcas epixenéticas específicas, tanto como indicadores do estado metabólico actual como como predictores do risco futuro de obesidade e enfermidades metabólicas. Un aspecto particularmente importante dos estudos en animais é que permiten a avaliación dos cambios epixenéticos nos tecidos diana, incluíndo o fígado e o hipotálamo, o que é moito máis difícil en humanos. Ademais, a capacidade de recoller grandes cantidades de tecido fresco fai posible avaliar múltiples marcas de cromatina así como a metilación do ADN. Algunhas destas modificacións epixenéticas só ou en combinación poden responder á programación ambiental. En modelos animais, tamén é posible estudar varias xeracións de descendentes e permitir así a diferenciación entre a transmisión transxeracional e interxeracional do risco de obesidade mediada pola memoria epixenética do estado nutricional dos pais, que non se pode distinguir facilmente nos estudos humanos. Usamos o primeiro termo para a transmisión meiótica do risco en ausencia de exposición continuada mentres que o segundo implica principalmente a transmisión directa do risco a través da reprogramación metabólica do feto ou dos gametos.
Os modelos animais ofrecen oportunidades únicas para estudos altamente controlados que proporcionan unha visión mecanicista do papel de marcas epixenéticas específicas, tanto como indicadores do estado metabólico actual como como predictores do risco futuro de obesidade e enfermidades metabólicas. Un aspecto particularmente importante dos estudos en animais é que permiten a avaliación dos cambios epixenéticos nos tecidos diana, incluíndo o fígado e o hipotálamo, o que é moito máis difícil en humanos. Ademais, a capacidade de recoller grandes cantidades de tecido fresco fai posible avaliar múltiples marcas de cromatina así como a metilación do ADN. Algunhas destas modificacións epixenéticas só ou en combinación poden responder á programación ambiental. En modelos animais, tamén é posible estudar varias xeracións de descendentes e permitir así a diferenciación entre a transmisión transxeracional e interxeracional do risco de obesidade mediada pola memoria epixenética do estado nutricional dos pais, que non se pode distinguir facilmente nos estudos humanos. Usamos o primeiro termo para a transmisión meiótica do risco en ausencia de exposición continuada mentres que o segundo implica principalmente a transmisión directa do risco a través da reprogramación metabólica do feto ou dos gametos.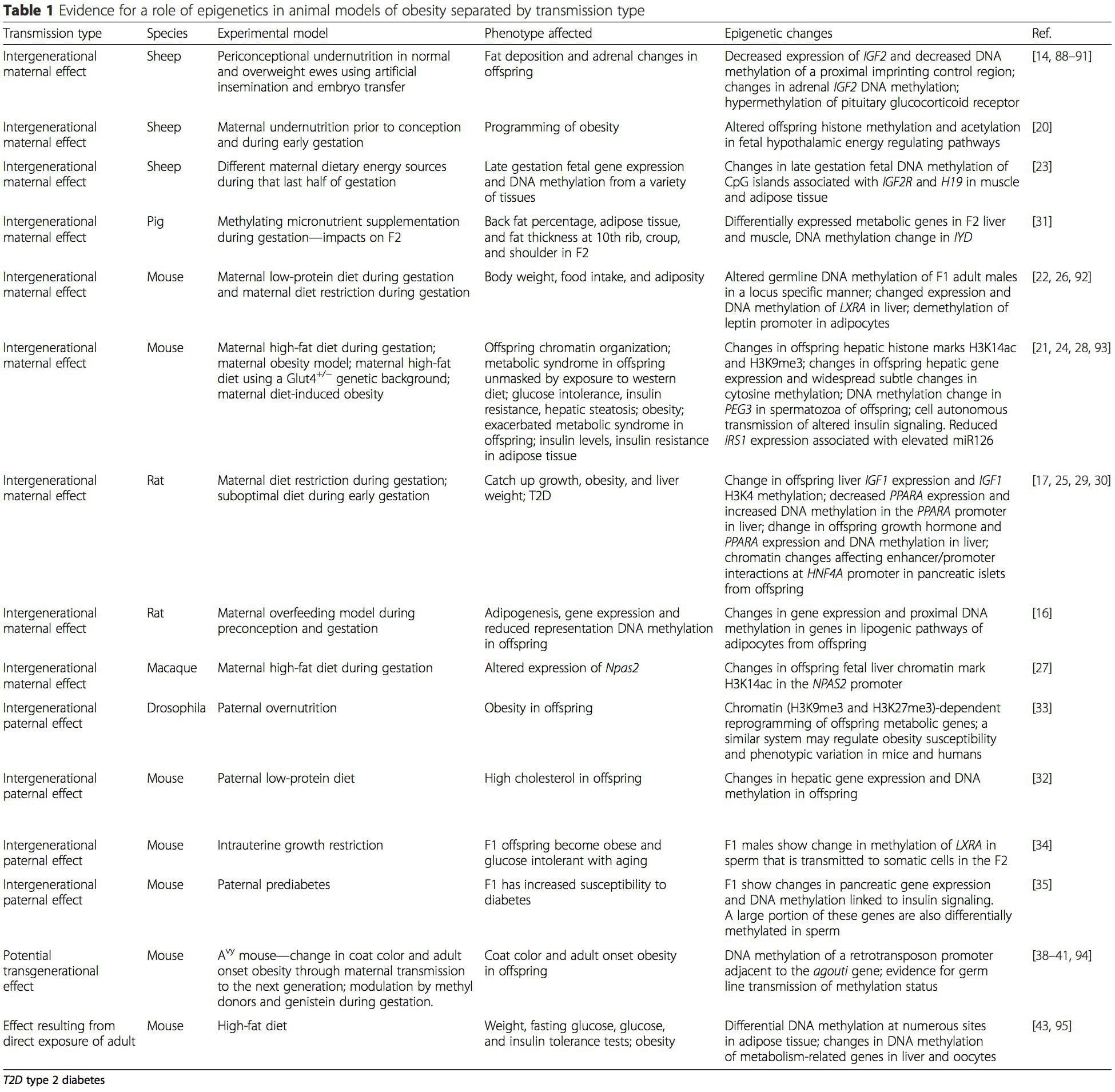 (i) Cambios epigenéticos na descendencia asociada á nutrición materna durante a xestación
(i) Cambios epigenéticos na descendencia asociada á nutrición materna durante a xestación A suplementación nutricional materna, a desnutrición e a sobrenutrición durante o embarazo poden alterar a deposición de graxa e a homeostase enerxética na descendencia [11, 13-15, 19]. Asociados a estes efectos na descendencia están os cambios na metilación do ADN, as modificacións postraducionais das histonas e a expresión xénica de varios xenes diana, especialmente os xenes que regulan o metabolismo dos ácidos graxos e a sinalización da insulina [16, 17, 20-30]. A diversidade de modelos animais utilizados nestes estudos e as vías metabólicas comúns afectadas suxiren unha resposta adaptativa conservada evolutivamente mediada pola modificación epixenética. Non obstante, poucos dos xenes específicos identificados e dos cambios epixenéticos foron validados cruzados en estudos relacionados, e normalmente non se aplicaron investigacións a gran escala de todo o xenoma. Un gran obstáculo para a comparación destes estudos son as diferentes ventás mentais de desenvolvemento sometidas a desafíos nutricionais, que poden provocar resultados considerablemente diferentes. Tamén é necesaria a proba de que os cambios epixenéticos son causais en lugar de estar asociados con cambios fenotípicos da descendencia. Isto requirirá a identificación dunha resposta epixenética de "memoria" inducida por nutrición dos pais que precede o desenvolvemento do fenotipo alterado na descendencia.
A suplementación nutricional materna, a desnutrición e a sobrenutrición durante o embarazo poden alterar a deposición de graxa e a homeostase enerxética na descendencia [11, 13-15, 19]. Asociados a estes efectos na descendencia están os cambios na metilación do ADN, as modificacións postraducionais das histonas e a expresión xénica de varios xenes diana, especialmente os xenes que regulan o metabolismo dos ácidos graxos e a sinalización da insulina [16, 17, 20-30]. A diversidade de modelos animais utilizados nestes estudos e as vías metabólicas comúns afectadas suxiren unha resposta adaptativa conservada evolutivamente mediada pola modificación epixenética. Non obstante, poucos dos xenes específicos identificados e dos cambios epixenéticos foron validados cruzados en estudos relacionados, e normalmente non se aplicaron investigacións a gran escala de todo o xenoma. Un gran obstáculo para a comparación destes estudos son as diferentes ventás mentais de desenvolvemento sometidas a desafíos nutricionais, que poden provocar resultados considerablemente diferentes. Tamén é necesaria a proba de que os cambios epixenéticos son causais en lugar de estar asociados con cambios fenotípicos da descendencia. Isto requirirá a identificación dunha resposta epixenética de "memoria" inducida por nutrición dos pais que precede o desenvolvemento do fenotipo alterado na descendencia. Estudos emerxentes demostraron que o plano paterno de nutrición pode afectar a deposición de graxa da descendencia e as marcas epixenéticas [31-34]. Unha investigación recente con ratos demostrou que a prediabetes paterna leva a unha maior susceptibilidade á diabetes na descendencia F1 con cambios asociados na expresión dos xenes pancreáticos e na metilación do ADN ligada á sinalización da insulina [35]. É importante destacar que houbo unha superposición destes cambios epixenéticos nos illotes pancreáticos e nos espermatozoides que suxiren a herdanza da liña xerminal. Non obstante, a maioría destes estudos, aínda que intrigantes nas súas implicacións, están limitados na escala xenómica de investigación e con frecuencia mostran alteracións epixenéticas débiles e algo transitorias asociadas a fenotipos metabólicos leves na descendencia.
Estudos emerxentes demostraron que o plano paterno de nutrición pode afectar a deposición de graxa da descendencia e as marcas epixenéticas [31-34]. Unha investigación recente con ratos demostrou que a prediabetes paterna leva a unha maior susceptibilidade á diabetes na descendencia F1 con cambios asociados na expresión dos xenes pancreáticos e na metilación do ADN ligada á sinalización da insulina [35]. É importante destacar que houbo unha superposición destes cambios epixenéticos nos illotes pancreáticos e nos espermatozoides que suxiren a herdanza da liña xerminal. Non obstante, a maioría destes estudos, aínda que intrigantes nas súas implicacións, están limitados na escala xenómica de investigación e con frecuencia mostran alteracións epixenéticas débiles e algo transitorias asociadas a fenotipos metabólicos leves na descendencia.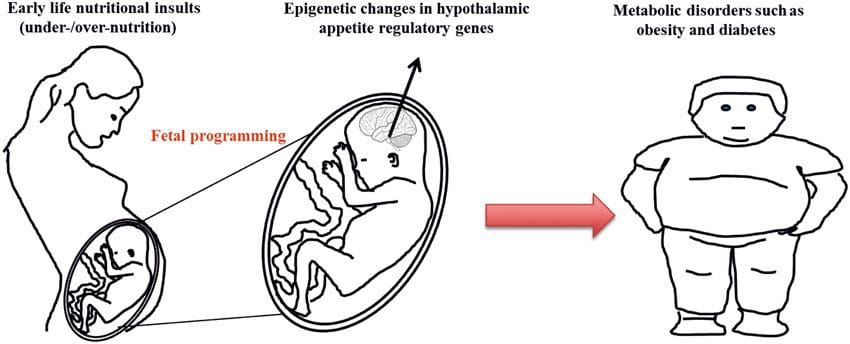 A transmisión estable de información epigenética en varias xeracións está ben descrita nos sistemas vexetais e C. elegans, pero a súa importancia nos mamíferos aínda é moi debatida [36, 37]. Estableceuse ben unha base epixenética para a transmisión dos avós de fenotipos en resposta a exposicións dietéticas, incluso nas especies gandeiras [31]. Os estudos máis influentes que demostran os efectos da transmisión epixenética que afectan o fenotipo da descendencia utilizaron o exemplo do rato viable agouti amarelo (Avy) [38]. Neste rato, a inserción dun retrotransposón augas arriba do xene agouti provoca a súa expresión constitutiva e a consecuente cor amarela do pelaje e a aparición da obesidade no adulto. A transmisión materna a través da liña xerminal produce un silenciamento da expresión de agutí mediado pola metilación do ADN, que dá como resultado unha cor de pelaxe de tipo salvaxe e un fenotipo delgado da descendencia [39, 40]. É importante destacar que os estudos posteriores nestes ratos demostraron que a exposición materna a doadores de metilo provoca un cambio na cor do pelaje [41]. Un estudo informou de transmisión dun fenotipo á xeración F3 e alteracións na expresión dun gran número de xenes en resposta á restrición de proteínas en F0 [42]; con todo, as alteracións na expresión foron moi variables e non se identificou un vínculo directo cos cambios epixenéticos neste sistema.
A transmisión estable de información epigenética en varias xeracións está ben descrita nos sistemas vexetais e C. elegans, pero a súa importancia nos mamíferos aínda é moi debatida [36, 37]. Estableceuse ben unha base epixenética para a transmisión dos avós de fenotipos en resposta a exposicións dietéticas, incluso nas especies gandeiras [31]. Os estudos máis influentes que demostran os efectos da transmisión epixenética que afectan o fenotipo da descendencia utilizaron o exemplo do rato viable agouti amarelo (Avy) [38]. Neste rato, a inserción dun retrotransposón augas arriba do xene agouti provoca a súa expresión constitutiva e a consecuente cor amarela do pelaje e a aparición da obesidade no adulto. A transmisión materna a través da liña xerminal produce un silenciamento da expresión de agutí mediado pola metilación do ADN, que dá como resultado unha cor de pelaxe de tipo salvaxe e un fenotipo delgado da descendencia [39, 40]. É importante destacar que os estudos posteriores nestes ratos demostraron que a exposición materna a doadores de metilo provoca un cambio na cor do pelaje [41]. Un estudo informou de transmisión dun fenotipo á xeración F3 e alteracións na expresión dun gran número de xenes en resposta á restrición de proteínas en F0 [42]; con todo, as alteracións na expresión foron moi variables e non se identificou un vínculo directo cos cambios epixenéticos neste sistema.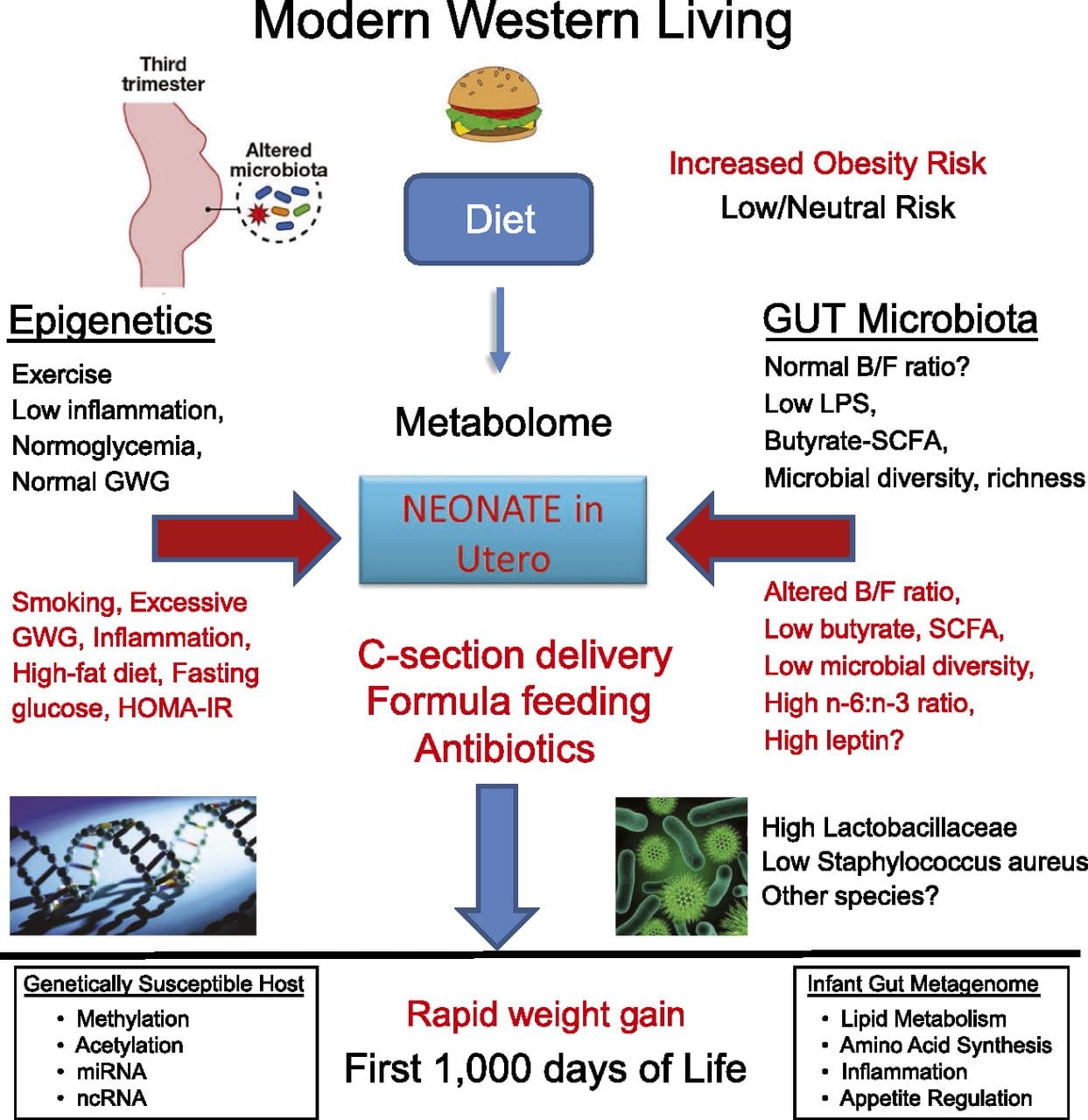 Aínda que moitos estudos identificaron modificacións epigenéticas asociadas á dieta en modelos animais utilizando rexións específicas de sitios candidatos, houbo poucas análises de todo o xenoma. Un estudo recente centrábase na determinación do impacto epixenético directo das dietas con alta graxa / obesidade inducida pola dieta en ratones adultos usando expresión xénica en todo o genoma e análises de metilación de ADN [43]. Este estudo identificou 232 rexións metiladas diferencialmente (DMRs) en adipocitos de control e ratos alimentados con alto contido de graxa. É importante destacar que as rexións humanas correspondentes para os DMR murinos tamén se metilaron de forma diferencial no tecido adiposo dunha poboación de humanos obesos e delgados, destacando así a notable conservación evolutiva destas rexións. Este resultado subliña a probable importancia dos DMR identificados na regulación da homeostase enerxética nos mamíferos.
Aínda que moitos estudos identificaron modificacións epigenéticas asociadas á dieta en modelos animais utilizando rexións específicas de sitios candidatos, houbo poucas análises de todo o xenoma. Un estudo recente centrábase na determinación do impacto epixenético directo das dietas con alta graxa / obesidade inducida pola dieta en ratones adultos usando expresión xénica en todo o genoma e análises de metilación de ADN [43]. Este estudo identificou 232 rexións metiladas diferencialmente (DMRs) en adipocitos de control e ratos alimentados con alto contido de graxa. É importante destacar que as rexións humanas correspondentes para os DMR murinos tamén se metilaron de forma diferencial no tecido adiposo dunha poboación de humanos obesos e delgados, destacando así a notable conservación evolutiva destas rexións. Este resultado subliña a probable importancia dos DMR identificados na regulación da homeostase enerxética nos mamíferos.
 (i) Estudos de asociación xenética. Os polimorfismos xenéticos que están asociados a un maior risco de desenvolver determinadas condicións están a priori ligados aos xenes causantes. A presenza de metilación diferencial nesas rexións infire a relevancia funcional destes cambios epixenéticos no control da expresión do xene(s) próximo(s). Hai fortes efectos xenéticos de acción cis que sustentan moita variación epixenética [7, 45] e, en estudos baseados na poboación, aplicáronse métodos que usan substitutos xenéticos para inferir un papel causal ou mediador das diferenzas epixenéticas [7, 46] . O uso de información xenética familiar tamén pode levar á identificación de rexións candidatas potencialmente causantes que mostran unha metilación diferencial relacionada co fenotipo [48].
(i) Estudos de asociación xenética. Os polimorfismos xenéticos que están asociados a un maior risco de desenvolver determinadas condicións están a priori ligados aos xenes causantes. A presenza de metilación diferencial nesas rexións infire a relevancia funcional destes cambios epixenéticos no control da expresión do xene(s) próximo(s). Hai fortes efectos xenéticos de acción cis que sustentan moita variación epixenética [7, 45] e, en estudos baseados na poboación, aplicáronse métodos que usan substitutos xenéticos para inferir un papel causal ou mediador das diferenzas epixenéticas [7, 46] . O uso de información xenética familiar tamén pode levar á identificación de rexións candidatas potencialmente causantes que mostran unha metilación diferencial relacionada co fenotipo [48].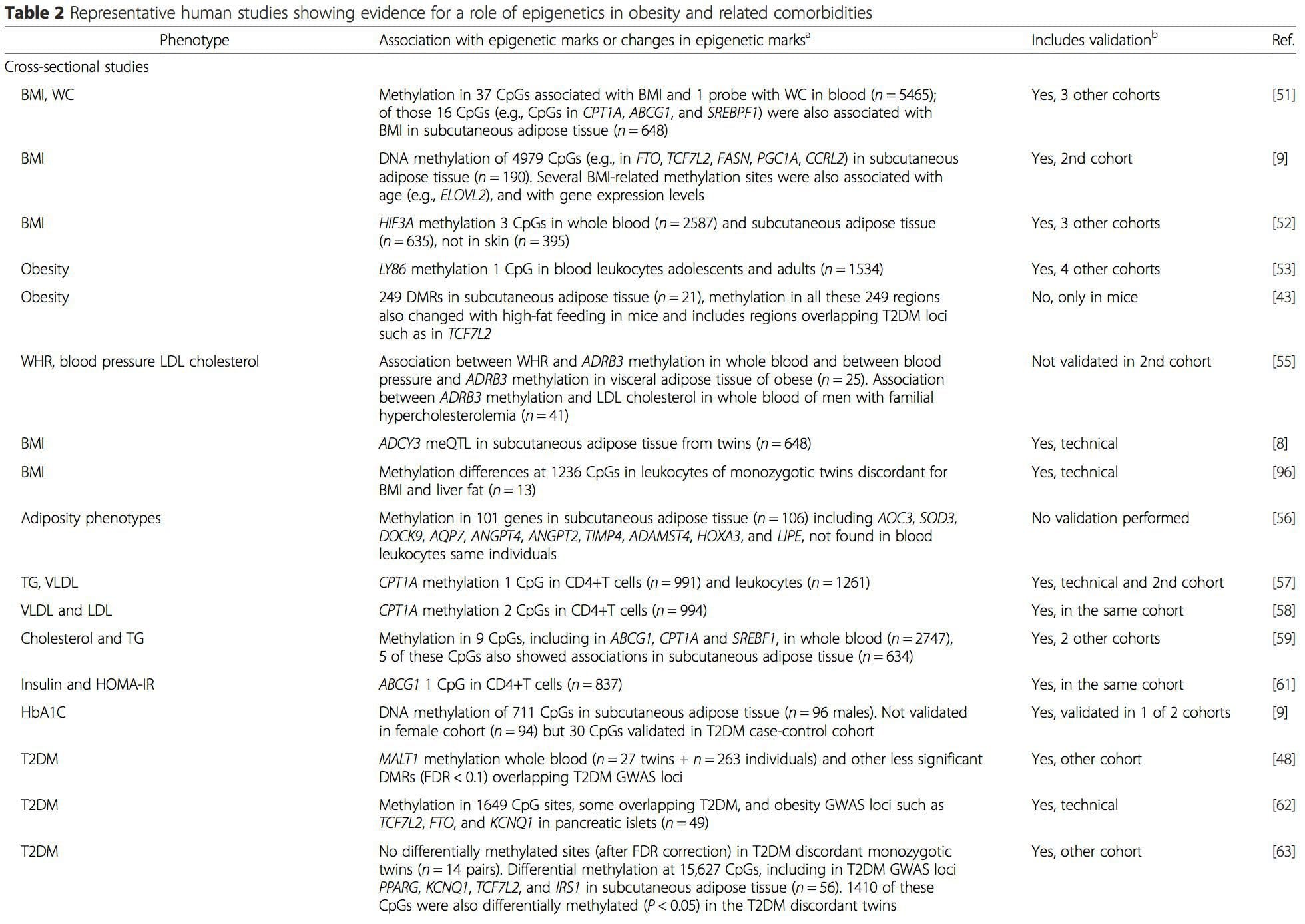
 A partir destes estudos, a metilación alterada de PGC1A, HIF3A, ABCG1 e CPT1A ea RXRA [18] descritas anteriormente xurdiron como biomarcadores asociados con, ou quizais preditivos, a saúde metabólica que tamén son candidatos plausibles para un papel no desenvolvemento da enfermidade metabólica .
A partir destes estudos, a metilación alterada de PGC1A, HIF3A, ABCG1 e CPT1A ea RXRA [18] descritas anteriormente xurdiron como biomarcadores asociados con, ou quizais preditivos, a saúde metabólica que tamén son candidatos plausibles para un papel no desenvolvemento da enfermidade metabólica .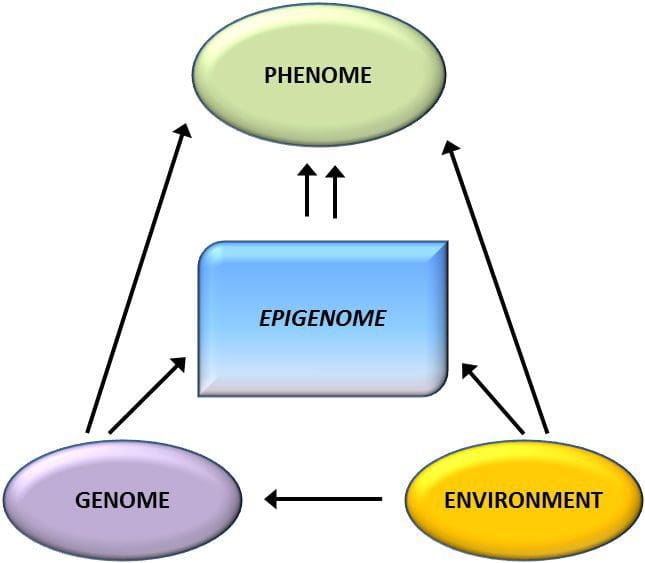 A variación epixenética está moi influenciada pola variación xenética subxacente, estimándose que o xenotipo explica o 20-40 % da variación [6, 8]. Recentemente, unha serie de estudos comezaron a integrar datos de metiloma e xenotipo para identificar loci de trazos cuantitativos de metilación (meQTL) asociados aos fenotipos de enfermidades. Por exemplo, no tecido adiposo, identificouse un meQTL que se solapa cun locus de risco xenético de IMC nun elemento potenciador augas arriba de ADCY3 [8]. Outros estudos tamén identificaron solapamentos entre os loci de risco coñecidos de obesidade e DM2 e DMR asociados á obesidade e DM2 [43, 48, 62]. A metilación dun número de tales DMR tamén foi modulada pola alimentación rica en graxas en ratos [43] e a perda de peso en humanos [64]. Estes resultados identifican un vínculo intrigante entre as variacións xenéticas relacionadas coa susceptibilidade á enfermidade e a súa asociación con rexións do xenoma que sofren modificacións epixenéticas en resposta a desafíos nutricionais, o que implica unha relación causal. A estreita conexión entre a variación xenética e epixenética pode significar os seus papeis esenciais na xeración de variación individual [65, 66]. Porén, aínda que estes achados suxiren que a metilación do ADN pode ser un mediador dos efectos xenéticos, tamén é importante considerar que tanto os procesos xenéticos como os epixenéticos poderían actuar de forma independente nos mesmos xenes. Os estudos de xemelgos [8, 63, 67] poden proporcionar información importante e indicar que as diferenzas interindividuais nos niveis de metilación do ADN xorden predominantemente de ambientes non compartidos e influencias estocásticas, mínimamente de efectos ambientais compartidos, pero tamén cun impacto significativo da xenética. variación.
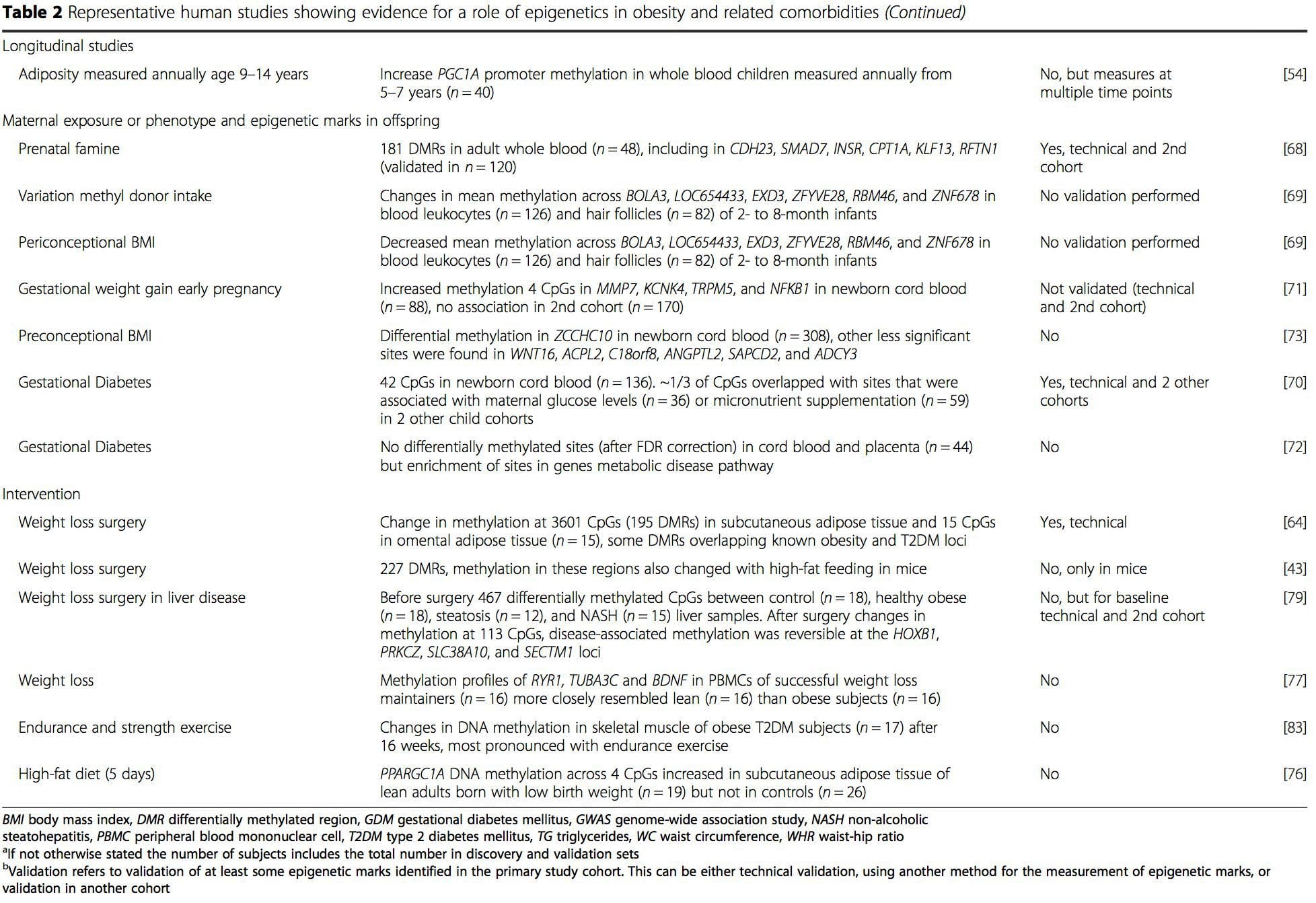
A variación epixenética está moi influenciada pola variación xenética subxacente, estimándose que o xenotipo explica o 20-40 % da variación [6, 8]. Recentemente, unha serie de estudos comezaron a integrar datos de metiloma e xenotipo para identificar loci de trazos cuantitativos de metilación (meQTL) asociados aos fenotipos de enfermidades. Por exemplo, no tecido adiposo, identificouse un meQTL que se solapa cun locus de risco xenético de IMC nun elemento potenciador augas arriba de ADCY3 [8]. Outros estudos tamén identificaron solapamentos entre os loci de risco coñecidos de obesidade e DM2 e DMR asociados á obesidade e DM2 [43, 48, 62]. A metilación dun número de tales DMR tamén foi modulada pola alimentación rica en graxas en ratos [43] e a perda de peso en humanos [64]. Estes resultados identifican un vínculo intrigante entre as variacións xenéticas relacionadas coa susceptibilidade á enfermidade e a súa asociación con rexións do xenoma que sofren modificacións epixenéticas en resposta a desafíos nutricionais, o que implica unha relación causal. A estreita conexión entre a variación xenética e epixenética pode significar os seus papeis esenciais na xeración de variación individual [65, 66]. Porén, aínda que estes achados suxiren que a metilación do ADN pode ser un mediador dos efectos xenéticos, tamén é importante considerar que tanto os procesos xenéticos como os epixenéticos poderían actuar de forma independente nos mesmos xenes. Os estudos de xemelgos [8, 63, 67] poden proporcionar información importante e indicar que as diferenzas interindividuais nos niveis de metilación do ADN xorden predominantemente de ambientes non compartidos e influencias estocásticas, mínimamente de efectos ambientais compartidos, pero tamén cun impacto significativo da xenética. variación. Entorno prenatal: Dous estudos publicados recentemente fixeron uso de poboacións humanas que experimentaron variacións "naturais" no abastecemento de nutrientes para estudar o impacto da nutrición materna antes ou durante o embarazo na metilación do ADN na descendencia [68, 69]. O primeiro estudo utilizou unha cohorte nai-fillo de Gambia para demostrar que tanto as variacións estacionais na inxestión de doantes maternos de metilo durante o embarazo como o IMC materno antes do embarazo estaban asociadas cunha metilación alterada nos bebés [69]. O segundo estudo utilizou descendentes adultos da cohorte holandesa Hunger Winter para investigar o efecto da exposición prenatal a un período agudo de desnutrición materna severa na metilación do ADN dos xenes implicados no crecemento e metabolismo na idade adulta [68]. Os resultados destacaron a importancia do momento da exposición no seu impacto no epixenoma, xa que só se identificaron efectos epixenéticos significativos en individuos expostos á fame durante a xestación temperá. É importante destacar que os cambios epixenéticos ocorreron xunto co aumento do IMC; con todo, non foi posible establecer neste estudo se estes cambios estaban presentes antes na vida ou unha consecuencia do maior IMC.
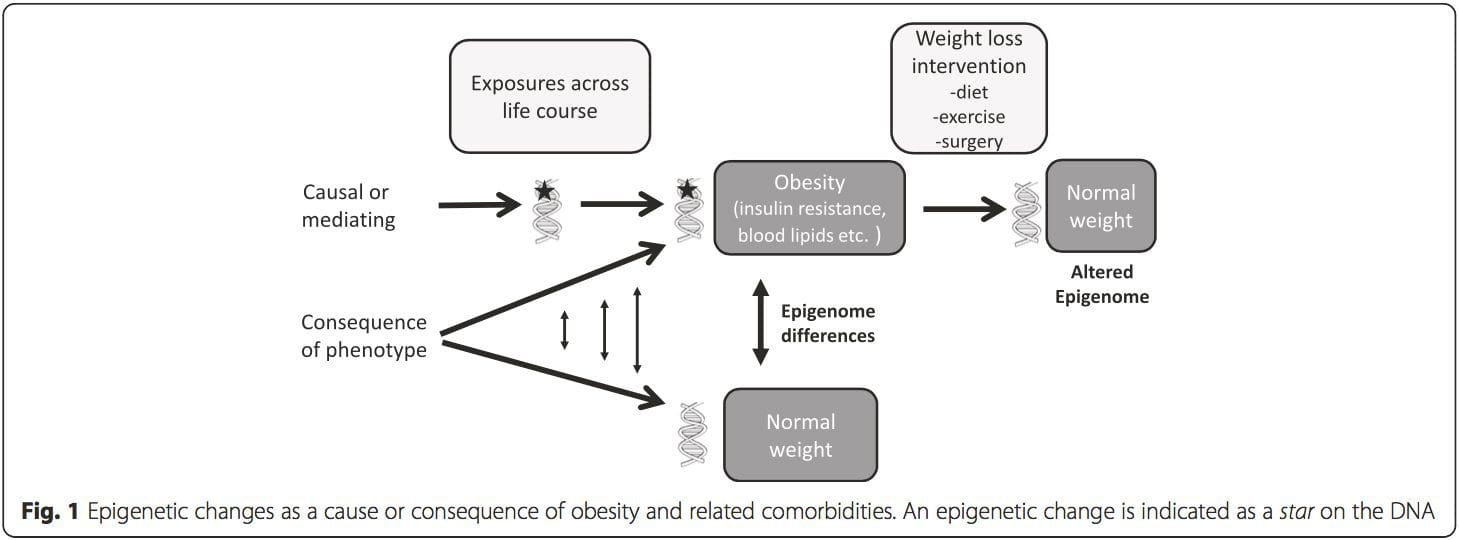
Entorno prenatal: Dous estudos publicados recentemente fixeron uso de poboacións humanas que experimentaron variacións "naturais" no abastecemento de nutrientes para estudar o impacto da nutrición materna antes ou durante o embarazo na metilación do ADN na descendencia [68, 69]. O primeiro estudo utilizou unha cohorte nai-fillo de Gambia para demostrar que tanto as variacións estacionais na inxestión de doantes maternos de metilo durante o embarazo como o IMC materno antes do embarazo estaban asociadas cunha metilación alterada nos bebés [69]. O segundo estudo utilizou descendentes adultos da cohorte holandesa Hunger Winter para investigar o efecto da exposición prenatal a un período agudo de desnutrición materna severa na metilación do ADN dos xenes implicados no crecemento e metabolismo na idade adulta [68]. Os resultados destacaron a importancia do momento da exposición no seu impacto no epixenoma, xa que só se identificaron efectos epixenéticos significativos en individuos expostos á fame durante a xestación temperá. É importante destacar que os cambios epixenéticos ocorreron xunto co aumento do IMC; con todo, non foi posible establecer neste estudo se estes cambios estaban presentes antes na vida ou unha consecuencia do maior IMC. Ambiente posparto: O epixenoma establécese de novo durante o desenvolvemento embrionario e, polo tanto, o medio prenatal probablemente teña o impacto máis significativo no epixenoma. Non obstante, agora está claro que se producen cambios no epixenoma "maduro" baixo a influencia dunha serie de condicións, incluíndo o envellecemento, a exposición a toxinas e as alteracións da dieta. Por exemplo, demostráronse cambios na metilación do ADN en numerosos xenes do músculo esquelético e PGC1A no tecido adiposo en resposta a unha dieta rica en graxas [75, 76]. As intervencións para perder masa de graxa corporal tamén se asociaron con cambios na metilación do ADN. Os estudos informaron de que os perfís de metilación do ADN do tecido adiposo [43, 64], das células mononucleares do sangue periférico [77] e do tecido muscular [78] en pacientes anteriormente obesos semellan máis aos perfís dos suxeitos delgados despois da perda de peso. A cirurxía de perda de peso tamén reverteu parcialmente os cambios de metilación no fígado asociados á enfermidade do fígado graso non alcohólico [79] e noutro estudo levou á hipometilación de múltiples xenes candidatos á obesidade, con efectos máis pronunciados na graxa subcutánea en comparación coa graxa omental (visceral) [64] . A evidencia acumulada suxire que as intervencións de exercicio tamén poden influír na metilación do ADN. A maioría destes estudos realizáronse en individuos delgados [80-82], pero un estudo de exercicios en suxeitos obesos con DM2 tamén demostrou cambios na metilación do ADN, incluídos nos xenes implicados no transporte de ácidos graxos e glicosa [83]. Os cambios epixenéticos tamén se producen co envellecemento e os datos recentes suxiren un papel da obesidade no seu aumento [9, 84, 85]. A obesidade acelerou a idade epixenética do tecido hepático, pero en contraste cos resultados descritos anteriormente, este efecto non foi reversible despois da perda de peso [84].
Ambiente posparto: O epixenoma establécese de novo durante o desenvolvemento embrionario e, polo tanto, o medio prenatal probablemente teña o impacto máis significativo no epixenoma. Non obstante, agora está claro que se producen cambios no epixenoma "maduro" baixo a influencia dunha serie de condicións, incluíndo o envellecemento, a exposición a toxinas e as alteracións da dieta. Por exemplo, demostráronse cambios na metilación do ADN en numerosos xenes do músculo esquelético e PGC1A no tecido adiposo en resposta a unha dieta rica en graxas [75, 76]. As intervencións para perder masa de graxa corporal tamén se asociaron con cambios na metilación do ADN. Os estudos informaron de que os perfís de metilación do ADN do tecido adiposo [43, 64], das células mononucleares do sangue periférico [77] e do tecido muscular [78] en pacientes anteriormente obesos semellan máis aos perfís dos suxeitos delgados despois da perda de peso. A cirurxía de perda de peso tamén reverteu parcialmente os cambios de metilación no fígado asociados á enfermidade do fígado graso non alcohólico [79] e noutro estudo levou á hipometilación de múltiples xenes candidatos á obesidade, con efectos máis pronunciados na graxa subcutánea en comparación coa graxa omental (visceral) [64] . A evidencia acumulada suxire que as intervencións de exercicio tamén poden influír na metilación do ADN. A maioría destes estudos realizáronse en individuos delgados [80-82], pero un estudo de exercicios en suxeitos obesos con DM2 tamén demostrou cambios na metilación do ADN, incluídos nos xenes implicados no transporte de ácidos graxos e glicosa [83]. Os cambios epixenéticos tamén se producen co envellecemento e os datos recentes suxiren un papel da obesidade no seu aumento [9, 84, 85]. A obesidade acelerou a idade epixenética do tecido hepático, pero en contraste cos resultados descritos anteriormente, este efecto non foi reversible despois da perda de peso [84].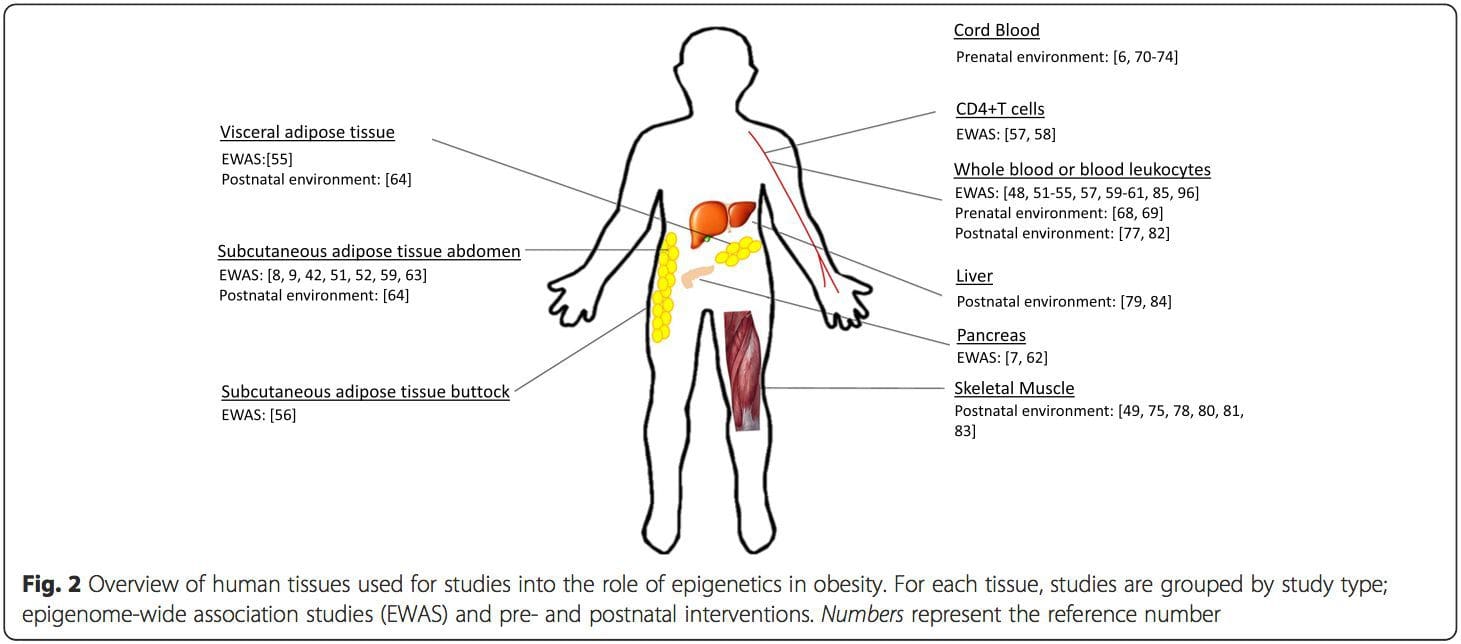 Conclusións
Conclusións



