Sulforaphane é un fitoquímico, unha sustancia dentro do grupo isotiocianato de compostos orgánicos, atopados en vexetais crucíferos, como o brócoli, a col, a coliflor e as coles de Bruxelas. Tamén se pode atopar en bok choy, kale, colards, mostaza e berros. Estudos de investigación demostraron que o sulforaphane pode axudar a previr varios tipos de cancro activando a produción de Nrf2, ou factor relacionado co factor eritroide 2 nuclear, un factor de transcrición que regula os mecanismos antioxidantes protectores que controlan a resposta da célula aos oxidantes. O propósito do seguinte artigo é describir a función do sulforafano.
Contidos
Abstracto
O sistema antioxidante KEAP1-Nrf2-ARE é un medio principal mediante o cal as células responden a tensións oxidativas e xenobióticas. O Sulforaphane (SFN), un isotiocianato electrofílico derivado de vexetais cruciferos, activa a vía KEAP1-Nrf2-ARE e converteuse nunha molécula de interese no tratamento das enfermidades nas que o estrés oxidativo crónico ten un papel etiolóxico importante. Demostramos aquí que as mitocondrias das células epiteliais pigmentadas retinianas humanas (RPE-1) tratadas con SFN sofren unha hiperfusión que é independente tanto de Nrf2 como do seu inhibidor citoplasmático KEAP1. A fusión mitocondrial foi citoprotectora ao inhibir a formación de poros nas mitocondrias durante a apoptose e, de acordo con isto, mostramos Nrf2 independente, a citoprotección de células tratadas con SFN expostas ao inductor da apoptosis, a staurosporina. Mecanicamente, a SFN mitiga o recrutamento e / ou retención do factor de fisión soluble Drp1 para a mitocondria e para os peroxisomas pero non afecta a abundancia xeral de Drp1. Estes datos demostran que as propiedades benéficas do SFN se estenden máis aló da activación do sistema KEAP1-Nrf2-ARE e xustifica un maior interrogatorio dado o uso actual deste axente en varios ensaios clínicos.
Palabras clave: Sulforaphane, Nrf2, Drp1, mitocondria, fisión, fusión, apoptosis.
introdución
Sulforaphane é un inhibidor independente da fisión mitocondrial Nrf2
Sulforaphane (SFN) é un composto de isotiocianato derivado na dieta máis comúnmente procedente de vexetais crucíferos [56]. Se xera nas plantas como unha resposta xenobiótica á depredación mediante a liberación vesicular da enzima hidroslítica miosinasa das células danadas; este enzima converte os glucosinolatos aos isotiocyantes [42]. Durante as últimas dúas décadas, SFN caracterizouse extensamente polas súas propiedades anti-cancerígenas, antioxidantes e antimicrobianas [57]. Gran parte desta eficacia foi atribuída á capacidade de SFN para modular a vía de sinalización do elemento de resposta antioxidante KEAP1-Nrf2 (ARE), aínda que se identificaron actividades adicionais do composto, incluíndo a inhibición da actividade da histona desacetilase e da progresión do ciclo celular [ 29]. Nrf2 é o factor de transcrición antioxidante mestre e baixo condicións de homeostase, a súa estabilidade é suprimida pola acción do complexo citoplasmático Cullin3KEAP1 ubiquitin ligase [20]. En concreto, Nrf2 é reclutado na ligase Cullin3KEAP1 uniéndose ao adaptador de substrato dimérico KEAP1 e posteriormente modifícase con cadeas de poliúbixas que apuntan ao factor de transcrición para a degradación mediada por proteases. Este volume de negocio constitutivo limita a vida media de Nrf2 en celas non estruturadas a ~ 15 min [30], [33], [46], [55]. En resposta a numerosos tipos de estrés, o máis notable é o estrés oxidativo, a KEAP1, unha proteína rica en cisteína, actúa como un sensor redox, ea modificación oxidativa das cisteínas críticas, particularmente C151, de KEAPXUMX separa a NRF1-KEAP2 de CUL1 e impide a degradación de Nrf3 [ 2], [8], [20]. Notablemente, SFN e posiblemente outros activadores Nrf55 imitan o estrés oxidativo modificando C2 de KEAP151, por exemplo [1]. A estabilización de Nrf21 permite a súa translocación ao núcleo onde induce a expresión dunha batería de xenes antioxidantes e de desintoxicación da Fase II. Nrf2 únese aos elementos promotores de resposta antioxidante (ARE) dos seus xenes metais asociados a través da heterodimerización con pequenas proteínas Maf [2]. Este sistema presenta unha resposta dinámica e sensible a antioxidantes indirectos como o SFN, os radicais libres xerados polas mitocondrias [19] ou outras fontes fisiolóxicas de estrés oxidativo [16].
As mitocondrias son orgánicas dinámicas e subcelulares que regulan unha serie de funcións celulares que van desde a produción de ATP e tampón intracelular de calcio ata a regulación redox e apoptose [13], [49]. As mitocondrias tamén representan a principal fonte de especies reactivas de osíxeno (ROS) dentro da célula. A regulación adecuada da función mitocondrial é, polo tanto, necesaria para optimizar a produción de ATP para satisfacer as necesidades móbiles, minimizando simultaneamente os efectos potencialmente nocivos da produción excesiva de radicais libres. Un requisito fundamental para a modulación fina da función mitocondrial é a capacidade para que as mitocondrias funcionen de xeito independente como máquinas bioquímicas e como parte dunha ampla rede de sensibilidade.
A morfoloxía ea función da rede mitocondrial están determinadas por un equilibrio regulado entre a fisión ea fusión. A fisión mitocondrial é necesaria para a herdanza da célula filla das mitocondrias durante a división celular [28], así como para a degradación selectiva e autofásica das mitocondrias despolarizadas ou danadas, denominada mitófago [1]. Por outra banda, a fusión é necesaria para a complementación de xenomas mitocondriales e compartindo compoñentes de cadea de transporte de electróns entre as mitocondrias veciñas [54]. No nivel molecular, a fisión e a fusión mitocondrial están reguladas por GTPases grandes e dinámicas. Tres encimas regulan principalmente a fusión: as Mitofusinas 1 e 2 (Mfn1 / 2) son proteínas de membrana externa de dous pases que median a fusión de membrana externa mediante interaccións heterotípicas entre mitocondrias adxacentes [15], [25], [37], mentres OPA1 é un elemento interno. proteína de membrana que simultaneamente garante a conectividade matricial regulando a fusión das membranas internas [5]. A actividade de GTPase das tres proteínas é necesaria para unha fusión robusta [5], [18] e OPA1 tamén está regulada pola proteólise complexa dentro da membrana mitocondrial interna das proteases OMA1 [14], PARL [6] e YME1L [45 ]. Importante, o potencial de membrana mitocondrial intacto é necesaria para a fusión eficiente para eliminar a integración de mitocondrias danadas e saudables [26].
A fisión mitocondrial está catalizada principalmente por unha proteína citosólica chamada 1 (Drp1 / DNM1L). Drp1 é reclutado desde o citosol ata sitios prospectivos de fisión na membrana externa mitocondrial [43]. Os principais receptores de Drp1 na membrana externa son o factor de fisión mitocondrial (Mff) [32] e, en menor medida, Fission 1 (Fis1) [51]. Adicionalmente, descubriuse un receptor señuelo, MIEF1 / MiD51, que actúa para limitar aínda máis a actividade da proteína Drp1 en sitios de fisión potenciais [58]. Unha vez atrapado na membrana externa mitocondrial, Drp1 oligomeriza en estruturas semellantes a espiral ao redor do corpo da mitocondria e logo utiliza a enerxía derivada da hidrólise GTP para mediar a escissió física das membranas exteriores e internas mitocondrial [17]. Os túbulos derivados do retículo endoplasmático actúan como un constrictor inicial das mitocondrias antes da oligomerización Drp1, subliñando a revelación de que as mitocondrias non constrictas son máis anchas que a circunferencia permisiva dunha espiral Drp1 completada [12]. A dinámica da actina tamén é importante para as interaccións ER-mitocondria que preceden á fisión mitocondrial [24]. Ademais do seu papel na fisión mitocondrial, Drp1 cataliza a fisión de peroxisomas [40].
Drp1 é moi semellante á proteína dinamina ben caracterizada porque ambas proteínas conteñen un dominio N-terminal GTPase, un dominio medio que é crítico para a auto-oligomerización e un dominio effector de GTPase C-terminal [31]. Drp1 logra a selectividade das membranas mitocondriales a través dunha combinación de interaccións coas súas proteínas receptoras Mff e Fis1 e tamén pola súa afinidade pola cardiolipina fosfolipídica específica da mitocondria a través do único dominio B-insert de Drp1 [2]. Drp1 normalmente existe como un homotetramer no citoplasma e un conxunto de orde superior nos sitios de fisión mitocondrial está mediado polo dominio medio de Drp1 [3].
Dada a conexión implícita entre a función mitocondrial ea vía KEAP1-Nrf2-ARE, investigamos os efectos da activación de Nrf2 na estrutura e función mitocondrial. Aquí demostramos que SFN induce hiperfusión mitocondrial que, inesperadamente, é independente tanto de Nrf2 como de KEAP1. Este efecto de SFN é a través dunha inhibición da función Drp1. Seguimos demostrando que SFN confire resistencia á apoptose que é independente de Nrf2 e que imita o observado nas células esgotadas de Drp1. Estes datos indican colectivamente que ademais de estabilizar e activar Nrf2, SFN modula a dinámica mitocondrial e preserva a aptitude e supervivencia móbil.
Resultados
Sulforaphane induce Nrf2 / KEAP1-independente hiperfusión de mitocondrias.
No curso de estudar os efectos da activación de Nrf2 na dinámica da rede mitocondrial, descubrimos que o tratamento de células epiteliais pigmentarias da retina humana inmortalizadas (RPE-1) con sulforafano (SFN), un potente activador da sinalización de Nrf2, inducía unha fusión robusta de a rede mitocondrial en comparación coas células de control tratadas con vehículos (Fig. 1A e B). A morfoloxía das mitocondrias destas células semellaba moito á das mitocondrias nas células esgotadas por ARNsi de Drp1 endóxeno, o principal factor de fisión mitocondrial (Fig. 1A). Este resultado suscita a intrigante idea de que o estado de fisión e fusión mitocondrial responde directamente aos niveis de Nrf2 na célula. Non obstante, a estimulación das células con outros estabilizadores e activadores de Nrf2, como o inhibidor do proteasoma MG132, o tBHQ pro-oxidante ou o derrubamento do inhibidor de Nrf2 KEAP1, non induciu a fusión mitocondrial (Fig. 1A e B). A estabilización de Nrf2 por estas manipulacións foi confirmada por transferencia western para Nrf2 endóxeno (Fig. 1C). Ademais, a expresión de Nrf2 era prescindible para a fusión mitocondrial inducida por SFN, xa que o derrubamento de Nrf2 endóxeno con ARNsi non conseguiu contrarrestar este fenotipo (Fig. 1D�F). Debido a que SFN estimula a vía KEAP1-Nrf2-ARE modificando covalentemente os residuos de cisteína de KEAP1 [21], eliminamos KEAP1 para resolver se a hiperfusión mitocondrial inducida por SFN se estimula a través dunha vía dependente de KEAP1, pero independente de Nrf2. Non obstante, o esgotamento de KEAP1 tampouco logrou anular a fusión mitocondrial inducida por SFN (Fig. 1G�I). De feito, SFN reverteu a morfoloxía pro-fisión inducida polo esgotamento de KEAP1 (Fig. 1G, panel b versus panel d). Estes resultados indican que o tratamento con SFN provoca a fusión mitocondrial independentemente da vía canónica KEAP1-Nrf2-ARE e levounos a interrogar se a SFN afecta directamente aos compoñentes da maquinaria de fisión ou de fusión mitocondrial.
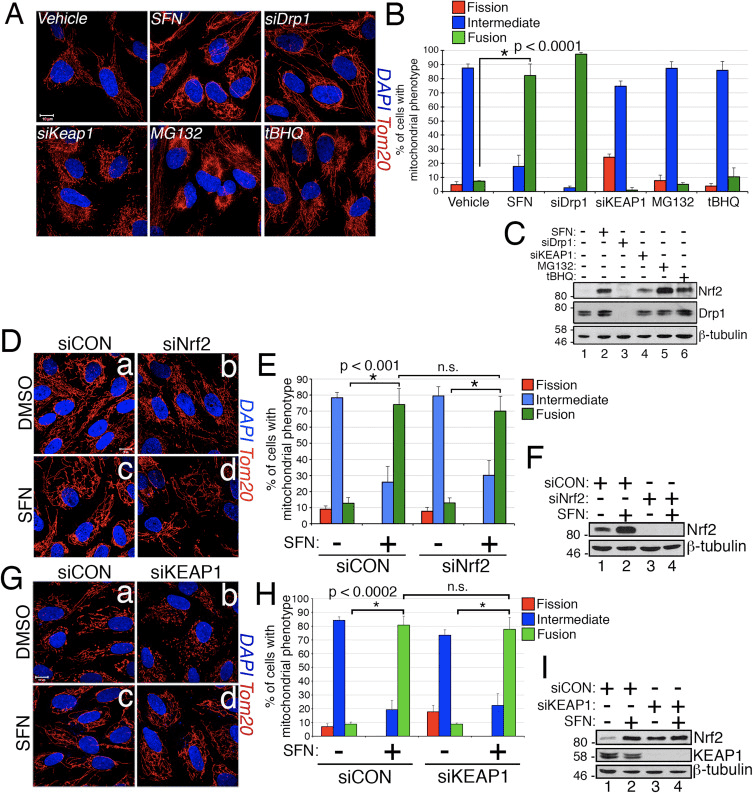
Sulforaphane impide a asociación mitocondrial de Drp1
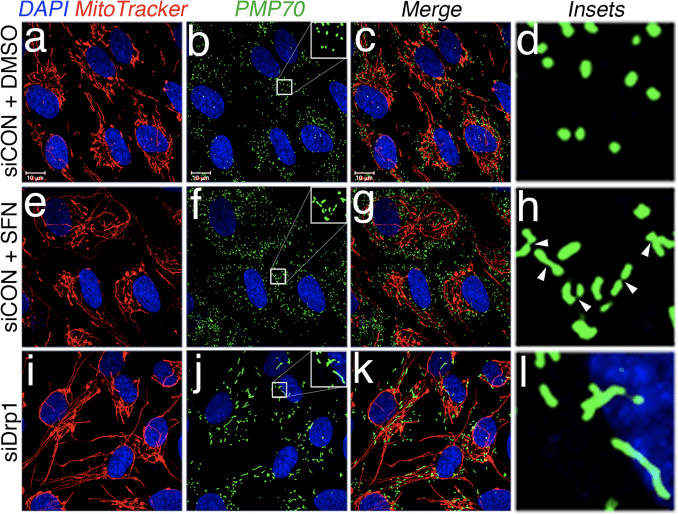
Con base no descubrimento de que o tratamento SFN induce a hiperfusión mitocondrial, razonamos que este fenotipo era unha consecuencia dunha excesiva actividade de fusión ou unha inhibición da actividade de fisión. Para discriminar estas dúas posibilidades, comparamos a morfoloxía dos peroxisomas na presenza e ausencia de SFN. Os peroxisomas son similares ás mitocondrias xa que son organelos dinámicos que a súa forma e lonxitude están constantemente en fluxo [44]. Os peroxisomas conteñen tanto Fis1 como Mff na súa membrana externa e, como consecuencia, son obxectivos para a fisión mediada por Drp1 [22], [23]. Non obstante, os peroxisomas non utilizan a maquinaria de fusión da rede mitocondrial e, en consecuencia, non sofren fusión [39]. Pola contra, a fisión peroxisomal oponse ao alargamiento dos peroxisomas existentes mediante a adición de novo de membranas e proteínas [44]. Debido a que os peroxisomas non teñen Mfn1 / 2 e OPA1, razonamos que se SFN activa a maquinaria de fusión en lugar de inhibir a maquinaria de fisión, a lonxitude do peroxisoma non se vería afectada. Nas células tratadas con vehículo, os peroxisomas son mantidos como organelos curtos, redondos e punctiformes (Fig. 2, paneis b e d). Non obstante, o tratamento SFN aumentou a lonxitude de peroxisoma por ~ 2 veces en comparación coas células de control (Fig. 2, paneles f e h). Ademais, moitos dos peroxisomas foron pinchados preto do centro, indicando un posible defecto de escissió (Fig. 2, panel h, punteiros). Do mesmo xeito, os peroxisomas nas células transfectadas con siRNA de Drp1 foron anormalmente longas (Fig. 2, paneles j e L), confirmando que Drp1 é necesaria para a fisión peroxisomal e suxire que o tratamento SFN causa fenotipos mitocondriais e peroxisomales ao interromper a máquina de fisión.
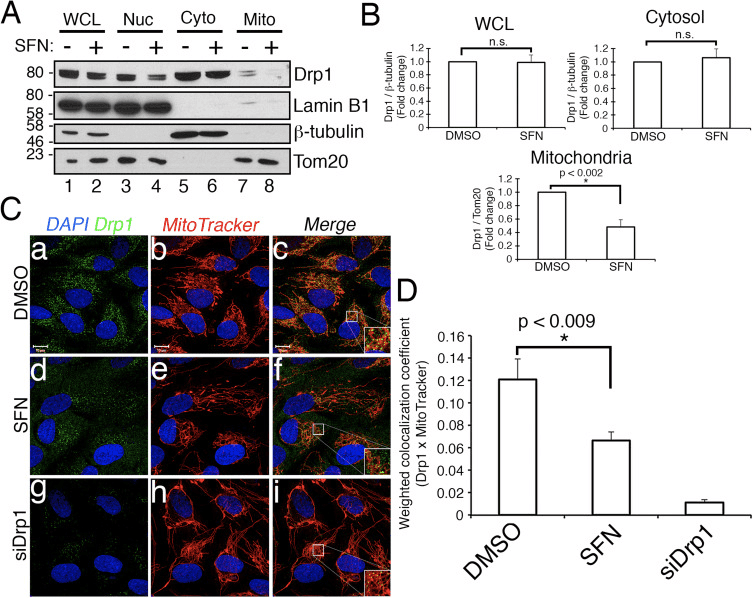
A continuación determinamos como SFN restrinxe a función Drp1. As posibilidades incluían reducións nos niveis de expresión, recrutamento/retención nas mitocondrias, oligomerización ou actividade enzimática da GTPase. Un déficit en calquera destes produciría unha redución da fisión e hiperfusión mitocondrial. Non detectamos cambios reproducibles nos niveis de proteína Drp1 despois do tratamento con SFN (Figs. 1C e 3A) e, polo tanto, concluímos que SFN non altera a estabilidade nin a expresión de Drp1, de acordo con que Drp1 ten unha vida media > 10 h [50] e os nosos tratamentos SFN sendo de menor duración. A continuación, investigamos se SFN afectou o recrutamento ou a retención de Drp1 nas mitocondrias. Estudos de fraccionamento mostraron que SFN inducía unha perda de Drp1 da fracción mitocondrial (Fig. 3A, pistas 7-8 e Fig. 3B). Como se informou anteriormente [43], só unha pequena fracción de Drp1 (~ 3%) está asociada coa rede mitocondrial nun momento dado durante as condicións de estado estacionario coa maior parte do encima residindo no citoplasma (Fig. 3A, pistas 5-8). ). Estes datos de fraccionamento confirmáronse mediante a análise de co-localización que mostrou unha redución de ~ 40% nos focos Drp1 puntuados e localizados nas mitocondrias despois do tratamento con SFN (Fig. 3C e D). En conxunto, estes datos indican que a fusión mitocondrial inducida pola SFN débese, polo menos parcialmente, á asociación atenuada de Drp1 coas mitocondrias. Os nosos datos non distinguen entre se SFN interfire co recrutamento mitocondrial fronte á retención mitocondrial de Drp1, ou ambos, xa que a análise do Drp1 endóxeno non era susceptible de visualizar a GTPase mediante microscopía de células vivas.
Sulforaphane confire protección contra a apoptosis inducida por Staurosportine independente de Nrf2
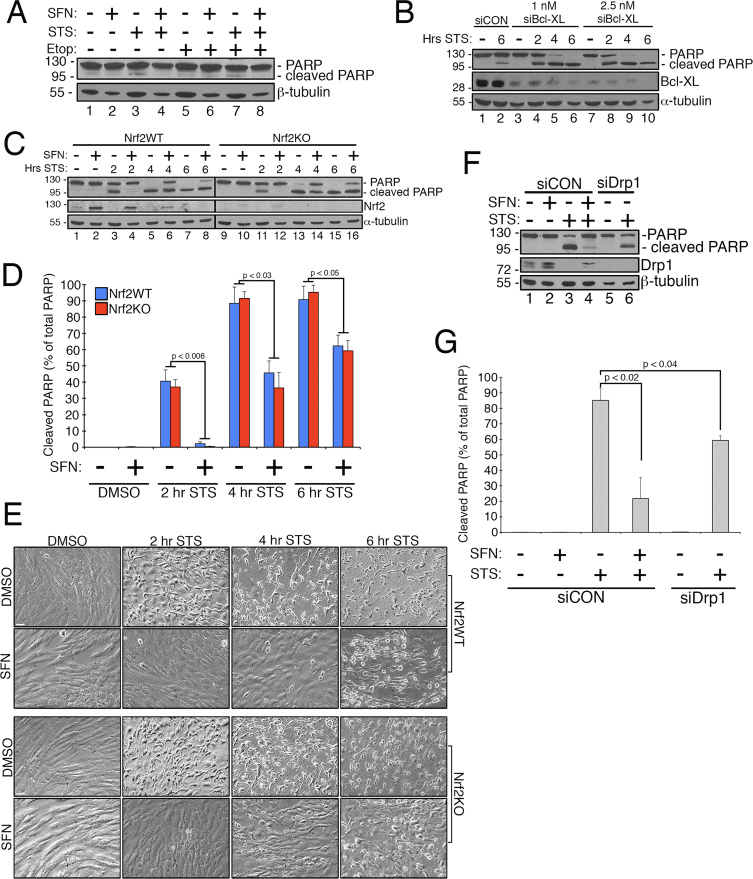
Traballos anteriores demostraron que a fisión mitocondrial é permisiva na formación de poros na membrana mitocondrial externa xerada por Bax/Bak durante a apoptose [11]. Demostrouse que Drp1 se recruta selectivamente nas mitocondrias durante a apoptose [11] e, consistente con isto, observáronse mitocondrias fragmentadas no inicio do proceso [27]. Pola contra, pénsase que a inhibición da fisión mitocondrial inhibe a apoptose ao bloquear a formación dos poros da membrana externa que permiten a liberación do citocromo c [53]. En consecuencia, a estimulación da fusión mitocondrial atrasa a progresión da apoptose inducida por compostos que inclúen a estaurosporina (STS) [14]. Para determinar se SFN protexe as células RPE-1 da apoptose mediada por STS e, se é así, se isto require Nrf2, establecemos un ensaio para inducir facilmente a escisión da poli ADP ribosa polimerase (PARP), un substrato da caspase-3 activada e un marcador definitivo de apoptose. O tratamento das células RPE-1 con 1 µM STS durante 6 h só causou unha escisión moi modesta de PARP, aínda que isto foi evitado mediante o cotratamento con SFN (por exemplo, figura 4A, pista 3 versus 4). Para aumentar a robustez deste ensaio, sensibilizamos aínda máis as células á apoptose inducida por STS pretratándoas con siRNA dirixido ao factor antiapoptótico, Bcl-XL. Este pretratamento reduciu a expresión de Bcl-XL e promoveu marcadamente a escisión de PARP en función do tempo exposto a STS (Fig. 4B, compare a pista 2 coas pistas 4-10). É importante destacar que 2 h de pretratamento con SFN mitigou a escisión de PARP nas células expostas a STS (Fig. 4C, pista 3 fronte a 4 e pista 5 fronte a 6). Así mesmo, as células esgotadas de forma estable de Nrf2 por CRISPR/Cas9 estaban protexidas de forma comparable contra a toxicidade de STS mediante o tratamento previo con SFN (Fig. 4C, carril 11 versus 12 e carril 13 versus 14 e Fig. 4D). Esta protección observouse usando tanto a escisión PARP (Fig. 4C e D) como a morfoloxía celular (Fig. 4E) como lecturas. A eficacia do esgotamento de Nrf2 por CRISPR/Cas9 foi confirmada por transferencia western (Fig. 4C, Nrf2 blot). Como estaba previsto, as células de esgotamento de Drp1, que tamén producen un fenotipo de hiperfusión (Fig. 1A), tamén bloqueou a escisión de PARP en resposta a STS en comparación coas células control incubadas con SFN (Fig. 4F e G). Xuntos, estes achados son consistentes con que SFN confire protección contra a apoptose pola súa capacidade de restrinxir a función Drp1, independentemente da estabilización e activación de Nrf2.
Conversa
Descubrimos que SFN modula a fisión mitocondrial / dinámica de fusión independentemente dos seus efectos na vía KEAP1-Nrf2-ARE. Isto é intrigante debido a un asumido vínculo entre a disfunción mitocondrial ea produción de ROS ea necesidade de destruír os radicais libres derivados da mitocondria mediante a activación de Nrf2. Este impacto funcional adicional de SFN é de importancia potencial tendo en conta os ensaios clínicos máis de 30 que se están a realizar probando SFN para o tratamento dunha variedade de enfermidades que inclúen o cancro de próstata, a enfermidade pulmonar obstrutiva e a enfermidade da célula falciforme [7], [10], [ 47].
Debido a que SFN é un isotiocianato [56] e activa a sinalización Nrf2 acilando directamente as cisteínas KEAP1 críticas para suprimir a degradación Nrf2 [21], segue que SFN exerce os seus efectos de pro-fusión modulando a actividade dun factor de fisión ou fusión mediante a modificación da cisteína . Os nosos datos apoian firmemente a Drp1 sendo regulada negativamente por SFN aínda que a GPGase sexa un obxectivo directo da acilación que queda por esclarecer. A pesar desta lagoa de coñecemento, a función de Drp1 está claramente comprometida por SFN xa que tanto as mitocondrias como os peroxisomas fanse hiperfundadas en resposta ao tratamento SFN e estes organelos comparten Drp1 polos seus respectivos eventos de scission [38]. Ademais, SFN diminúe a cantidade de Drp1 que se localiza e acumula nas mitocondrias (Fig. 3). Debido a que os nosos experimentos realizáronse con todas as proteínas endóxenas, a nosa detección de Drp1 nos sitios de fisión mitocondrial está baixo condicións de estado estable e, en consecuencia, non podemos distinguir entre un reclutamiento fronte a un defecto de retención do encima causado por SFN. Ademais, non podemos eliminar a posibilidade de que SFN acila un receptor nas mitocondrias (Fis1 ou Mff) para bloquear o reclutamiento Drp1 aínda, sospeitamos que Drp1 é directamente modificado. Drp1 ten nove cisteínas, das cales oito residen dentro do dominio medio que se require para a oligomerización [3], e unha das cales reside no dominio de efectos de GTPase (GED) no terminal C de Drp1. A acilación directa de calquera destas cisteínas pode causar un defecto de actividade no Drp1 e, polo tanto, subxace o efecto do SFN na dinámica mitocondrial. Notablemente, o traballo previo suxire que os defectos na oligomerización e actividade catalítica poden anular a retención de Drp1 na mitocondria [52]. Cys644 no dominio GED é un obxectivo particularmente atractivo baseado en traballos previos que amosan que a mutación desta cisteína acumula mutacións que afectan a actividade de Drp1 GTPase [4] e que esta particular cisteína é modificada por eletróxilos tiol-reactivos [9]. A resolución desta cuestión destacada esixirá a validación espectrométrica de masas. En resumo, identificamos unha novela, función citoprotectora para o composto clínico relevante SFN. Ademais de activar o factor de transcrición Nrf2, o SFN promueve a fusión mitocondrial e peroxisómica, e este efecto é independente de Nrf2. O mecanismo subxacente a este fenómeno implica unha redución na función da GTPase Drp1, o mediador principal da fisión mitocondrial e peroxisomal. Unha das principais consecuencias da fusión mitocondrial mediada por SFN é que as células se fan resistentes aos efectos tóxicos do inductor staurosporina de apoptosis. Esta acción citoprotectora adicional de SFN pode ser de utilidade clínica particular nas numerosas enfermidades neurodegenerativas para as que a idade é o principal factor de risco (por exemplo, a enfermidade de Parkinson, a enfermidade de Alzheimer, a dexeneración macular relacionada coa idade) xa que estas enfermidades foron asociadas con apoptosis e reducidas niveis e / ou disregulación de Nrf2 [35], [36], [48].
Materiais e Métodos
Ensaios de apoptose
As células sementáronse e transfectáronse con siRNA como se indica a continuación. As células foron pretratadas con sulforafano 50 µM durante 2 h para inducir a fusión mitocondrial e despois tratáronse con estaurosporina 1 ?M para inducir a apoptose. No momento da colleita, o medio foi recollido en tubos individuais e sometido a centrifugación a alta velocidade para sedimentar células apoptóticas. Este sedimento celular combinouse con células adherentes e solubilizouse en tampón de Laemmli 2 veces concentrado. As mostras foron sometidas a western blot anti-PARP.
CRISPR / Cas9 Construct Generation
Para crear LentiCRISPR / eCas9 1.1, LentiCRISPR v2 (addgene #52961) foi cortado por primeira vez con Age1 e BamH1. A continuación, SpCas9 de eSpCas9 1.1 (addgene #71814) foi PCR amplificado con Age1 e BamH1 overhangs utilizando os seguintes primers (Forward AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC, Reverse AAGCGCTAGAGTCTTTTTCTTTTTGCCTGGCCGG) e ligados no vector de corte anterior. As secuencias de sgRNA determináronse usando Benchling.com. Os parámetros fixáronse para segmentar a secuencia de codificación coas puntuacións máis altas na meta e as puntuacións máis baixas. As secuencias (secuencia de direcionamento subliñadas, HS sgNFE2L2 # 1 sentido CACCGCGACGGAAAGAGTATGAGC, anti-sentido AAACGCTCATACTCTTTCCGTCGC; hs sgNFE2L2 # 2 sentido CACCGGTTTCTGACTGGATGTGCT, AAACAGCACATCCAGTCAGAAACC anti-sentido; hs sgNFE2L2 # 3 sentido CACCGGAGTAGTTGGCAGATCCAC, anti-sentido AAACGTGGATCTGCCAACTACTCC) foron vinculados e conectados en BsmB1 cortar LentiCRISPR / eCas9 1.1. As células RPE-1 infectadas por lentenidade foron seleccionadas con puromicina e mantidas como unha poboación agrupada. O knockout foi confirmado por inmunofluorescencia e bloqueo occidental.
Cultura e transfeccións celulares
Cultiváronse células epiteliais pigmentarias retinianas humanas transformadas con telomerase (RPE-1) (ATCC) no medio Eagle modificado de Dulbecco (DMEM) que contén 1 g/L de glicosa complementado con penicilina, estreptomicina, cóctel de aminoácidos non esenciais 1X (Life Technologies). e 10% de soro fetal bovino (Life Technologies). Para as transfeccións de ARNsi, sementáronse 30,000-35,000 células/ml durante a noite. As células recibiron ARNsi 10 nM diluídos en DMEM sen soro e combinados cun reactivo de transfección de interferina ao 0.3% (PolyPlus). Para a sensibilización da apoptose, as células recibiron ARNsi de Bcl-XL 1 nM. As células recolléronse 2-3 días despois da transfección.
Produtos químicos, anticorpos e siRNA Oligos
Anticorpos contra ?-tubulina (Cell Signaling), ?-tubulina (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (Cell Signaling), PMP70 (Abcam) e Tom20 (BD Biosciences). ) utilizáronse en dilucións 1:1000 para a transferencia western e para a inmunofluorescencia. Na casa, o anticorpo de coello anti-Nrf2 utilizouse a 1:2000 para a transferencia western [34], [59]. Utilizáronse sulforafano (Sigma) e estaurosporina (Tocris) a 50 ?M e 1 ?M respectivamente. Os siRNA contra Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (Cell Signaling) e Bcl-XL (Cell Signaling) utilizáronse a 10 nM a non ser que se indique o contrario.
Inmunofluorescencia e etiquetado en Vivo
As células sementadas en cubreobjetos de vidro de 18 mm foron tratadas con vehículo ou fármaco, fixadas en formaldehido ao 3.7% e despois permeabilizadas en Triton X-0.2/PBS ao 100% en xeo durante 10 min. Os anticorpos primarios incubáronse en albúmina sérica bovina (BSA) ao 3% en PBS durante a noite a 4 °C. Despois de lavados con PBS, as células incubáronse durante 1 h en anticorpos secundarios conxugados Alexa488- ou Alexa546- apropiados para a especie (diluídos 1:1000) e 0.1 µg/mL de DAPI (Sigma) nun 3% de BSA/PBS. As mitocondrias visualizáronse mediante inmunofluorescencia anti-Tom20 ou incubando células en 200 nM MitoTracker Red CMXRos (Molecular Probes, Inc.) en DMEM sen soro durante 30 min a 37 °C antes da fixación.
Microscopía e análise de imaxes
As mostras de inmunofluorescencia foron vistas nun microscopio confocal LSM710 (Carl Zeiss). As micrografías foron capturadas usando obxectivos de inmersión en aceite 63X ou 100X e imaxes axustadas e melloradas usando Adobe Photoshop CS6. A análise de co-localización realizouse mediante a función de co-localización Carl Zeiss LSM710 con limiares establecidos manualmente mentres se cegaba á identidade das mostras. As barras de escala por todas partes, a menos que se indique o contrario, son de 10 µm. A morfoloxía mitocondrial avaliouse mediante puntuación cega. Se as mitocondrias dunha célula se mantiñan como puntos múltiple, redondos e discriminados, a célula puntuábase como "fisión". Se as mitocondrias individuais eran indistinguibles e toda a rede mitocondrial parecía continua, a célula puntuábase como "fusión". Todas as outras células, incluídas as que tiñan mitocondrias agrupadas, foron puntuadas como "intermedias".
Fraccións subcelulares
As células RPE-1 creceron ata a confluencia. Despois dun lavado con PBS, as células foron sometidas a centrifugación a 600 µg durante 10 min e resuspendidas en 600 µl de tampón de illamento (manitol 210 mM, sacarosa 70 mM, MOPS 5 mM, EDTA 1 mM pH 7.4 + 1 mM PMSF). A suspensión foi lisada 30 veces nun homoxeneizador Dounce. Unha fracción do homoxenado conservouse como un "lisado de células enteiras". O resto foi sometido a centrifugación a 800 µg durante 10 min para sedimentar os núcleos. Os sobrenadantes foron sometidos a centrifugación a 1500 µg durante 10 min para limpar os núcleos restantes e as células non lisadas. Este sobrenadante foi sometido a centrifugación a 15,000 µg durante 15 min para sedimentar as mitocondrias. O sobrenadante conservouse como a "fracción citosólica". O sedimento foi lavado suavemente con PBS e resuspendido nun tampón de illamento. A concentración de proteína de cada fracción foi medida por ensaio de ácido bicinconínico (BCA) e as cantidades equivalentes de proteína foron resoltas por SDS-PAGE.
Western Blotting
As células laváronse en PBS e solubilizáronse en tampón solubilizante Laemmli 2 veces concentrado (100 mM Tris [pH 6.8], 2% SDS, 0.008% azul de bromofenol, 2% 2-mercaptoetanol, 26.3% glicerol e 0.001% Pyrinin). Os lisados fervéronse durante 5 minutos antes de cargalos en xeles de poliacrilamida de dodecil sulfato de sodio (SDS). As proteínas foron transferidas a membranas de nitrocelulosa e as membranas foron bloqueadas durante 1 h en leite 5%/TBST. Os anticorpos primarios diluíronse en leite/TBST ao 5% e incubáronse coa mancha durante a noite a 4 °C. Os anticorpos secundarios conxugados á peroxidase de rábano picante (HRP) diluíronse en leite/TBST ao 5%. Procesáronse as manchas con quimioluminiscencia mellorada e realizáronse cuantificacións densitométricas mediante o software ImageJ.

Sulforaphane é unha substancia química da colección de isotiocianato das sustancias orgánulosas obtidas a partir de vexetais crucíferos, que inclúen o brócoli, a col, a coliflor, a colza e os colares, entre outros. Sulforaphane prodúcese cando a enzima myrosinase transforma glucoraphanin, un glucosinolato, nun sulforaphane, tamén coñecido como sulforaphane-glucosinolate. As coles de brócoli e coliflor teñen a maior concentración de glucoraphanina ou o precursor do sulforaphane. Os estudos de investigación demostraron que sulforaphane aumenta as capacidades antioxidantes do corpo humano para evitar varios problemas de saúde. Dr. Alex Jimenez DC, CCST Insight
Sulforaphane e os seus efectos sobre o cancro, a mortalidade, o envellecemento, o cerebro e o comportamento, as enfermidades cardíacas e moito máis
Os isotiocianatos son algúns dos compostos vexetais máis importantes que pode obter na súa dieta. Neste video fago o caso máis completo para eles que se fixo. ¿A atención curta? Saltar ao teu tema favorito premendo un dos puntos de tempo a continuación. Cadro de cronograma completo a continuación.
Seccións clave:
- 00: 01: 14 - Cáncer e mortalidade
- 00: 19: 04 - Envellecemento
- 00: 26: 30 - Cerebro e comportamento
- 00: 38: 06 - Recapitalización final
- 00: 40: 27 - Dose
Cadro de tempo completo:
- 00: 00: 34 - Introdución de sulforaphane, un foco principal do vídeo.
- 00: 01: 14 - Consumo e redución de vexetais cruciferos na mortalidade por todas as causas.
- 00: 02: 12 - Risco de cancro de próstata.
- 00: 02: 23 - Risco de cancro de vejiga.
- 00: 02: 34 - Cáncer de pulmón en risco de fumadores.
- 00: 02: 48 - Risco de cancro de mama.
- 00: 03: 13 - hipotético: e se xa ten cancro? (intervencionista)
- 00: 03: 35 - Mecanismo plausible que conduce os datos asociativos de cancro e mortalidade.
- 00: 04: 38 - Sulforaphane e cancro.
- 00: 05: 32 - Evidencia animal que mostra un forte efecto do extracto de brotes de brócoli no desenvolvemento de tumores vesicales en ratas.
- 00: 06: 06 - Efecto da suplementación directa de sulforaphane en pacientes con cancro de próstata.
- 00: 07: 09 - Bioacumulación de metabolitos de isotiocianato no tecido de mama real.
- 00: 08: 32 - Inhibición das células nais do cancro de mama.
- 00: 08: 53 - Lección de historia: as brassicas establecéronse con propiedades de saúde mesmo na Roma antiga.
- 00: 09: 16 - A capacidade de Sulforaphane para mellorar a excreción de carcinóxenos (benceno, acroleína).
- 00: 09: 51 - NRF2 como un cambio xenético a través de elementos de resposta antioxidante.
- 00: 10: 10 - Como a activación de NRF2 aumenta a excreción de carcinóxenos a través de glutatión-S-conjugados.
- 00: 10: 34 - As coles de Bruxelas aumentan a glutatión-S-transferasa e reducen o dano do ADN.
- 00: 11: 20 - A bebida de brote de brócoli aumenta a excreción de benceno por 61%.
- 00: 13: 31 - O homogeneio de brotes de brócoli aumenta as encimas antioxidantes nas vías aéreas superiores.
- 00: 15: 45 - Consumo de vexetais cruciferos e mortalidade cardíaca.
- 00: 16: 55 - O polbo de brócolis mellora os lípidos sanguíneos eo risco de enfermidade cardíaca en diabéticos tipo 2.
- 00: 19: 04 - Comezo da sección de envellecemento.
- 00: 19: 21 - A dieta enriquecida con Sulforaphane mellora a vida útil dos escaravellos de 15 a 30% (en certas condicións).
- 00: 20: 34 - Importancia da baixa inflamación por lonxevidade.
- 00: 22: 05 - As verduras cruciferas e os brotes de brócoli parecen reducir unha gran variedade de marcadores inflamatorios en humanos.
- 00: 23: 40 - Recapitalización media: cancro, seccións de envellecemento
- 00: 24: 14 - Os estudos do rato suxiren que o sulforaphano pode mellorar a función inmune adaptativa na vellez.
- 00: 25: 18 - Sulforaphane mellorou o crecemento do cabelo nun modelo de calvície de rato. Imaxe en 00: 26: 10.
- 00: 26: 30 - Comezo da sección do cerebro e do comportamento.
- 00: 27: 18 - Efecto do extracto de brotes de brócoli no autismo.
- 00: 27: 48 - Efecto da glucoraphanina na esquizofrenia.
- 00: 28: 17 - Inicio da discusión de depresión (mecanismo plausible e estudos).
- 00: 31: 21 - O estudo do rato usando 10 diferentes modelos de depresión inducida polo estrés mostran sulforaphane igualmente efectivo como a fluoxetina (prozac).
- 00: 32: 00 - O estudo mostra que a inxestión directa de glucoraphanina en ratos é igualmente eficaz na prevención da depresión do modelo de estrés da derrota social.
- 00: 33: 01 - Inicio da sección de neurodegeneración.
- 00: 33: 30 - Sulforaphane e enfermidade de Alzheimer.
- 00: 33: 44 - Sulforaphane e enfermidade de Parkinson.
- 00: 33: 51 - Sulforaphane e enfermidade de Hungtington.
- 00: 34: 13 - Sulforaphane aumenta as proteínas de choque térmico.
- 00: 34: 43 - Inicio da sección traumática de lesións cerebrais.
- 00: 35: 01 - Sulforaphane inxectado inmediatamente despois de que o TBI mellore a memoria (estudo do rato).
- 00: 35: 55 - Sulforaphane e plasticidade neuronal.
- 00: 36: 32 - Sulforaphane mellora a aprendizaxe en modelo de diabetes tipo II en ratos.
- 00: 37: 19 - Distrofia muscular sulforaphana e duxena.
- 00: 37: 44 - Inhibición da myostatina nas células satélite do músculo (in vitro).
- 00: 38: 06 - Recapitulación de última hora: mortalidade e cancro, danos no ADN, estrés oxidativo e inflamación, excreción de benceno, enfermidade cardiovascular, diabetes tipo II, efectos sobre o cerebro (depresión, autismo, esquizofrenia e neurodegeneración), vía NRF2.
- 00: 40: 27 - Pensamentos en descubrir unha dose de brotes de brócoli ou sulforaphane.
- 00: 41: 01 - Anécdotas sobre o xermelo na casa.
- 00: 43: 14 - Sobre as temperaturas de cocción e actividade sulforaphane.
- 00: 43: 45 - Conversión de bacterias gut de sulforaphane a partir de glucoraphanin.
- 00: 44: 24 - Os suplementos funcionan mellor cando se combinan con mirosinasa activa de vexetais.
- 00: 44: 56 - Técnicas de cociña e vexetais crucíferos.
- 00: 46: 06 - Isotiocianatos como goitrógenos.
Grazas
Sciencedirect.com/science/article/pii/S2213231716302750
Como se produce Sulforaphane?
A calefacción diminúe a actividade da proteína Epithiospecifier e aumenta a formación de Sulforaphane no brócoli
Abstracto
O sulforafano, un isotiocianato do brócoli, é un dos máis potentes anticanceríxenos derivados dos alimentos. Este composto non está presente no vexetal intacto, senón que fórmase a partir do seu precursor de glucosinolato, a glucorafanina, pola acción da mirosinase, unha enzima tioglucosidasa, cando o tecido de brócoli é esmagado ou mastigado. Non obstante, unha serie de estudos demostraron que o rendemento de sulforafano a partir da glucorafanina é baixo e que un análogo de nitrilo non bioactivo, o sulforafano nitrilo, é o principal produto de hidrólise cando o tecido vexetal é triturado a temperatura ambiente. Evidencias recentes suxiren que en Arabidopsis, a formación de nitrilo a partir de glucosinolatos está controlada por unha proteína sensible á calor, a proteína epitioespecificadora (ESP), un cofactor non catalítico da mirosinase. Os nosos obxectivos foron examinar os efectos do quecemento de floretes e brotes de brócoli sobre a formación de sulforafano e nitrilo de sulforafano, para determinar se o brócoli contén actividade ESP e, a continuación, correlacionar os cambios dependentes da calor na actividade ESP, contido de sulforafano e bioactividade, medida pola indución do enzima quinona reductase (QR) de desintoxicación de fase II en cultivo celular. O quecemento de floretes de brócoli frescos ou brotes de brócoli a 60 °C antes da homoxeneización aumentou simultáneamente a formación de sulforafano e diminuíu a formación de nitrilo de sulforafano. Unha perda significativa da actividade ESP paralela á diminución da formación de nitrilo de sulforafano. O quecemento a 70 °C e superior diminuíu a formación de ambos os produtos nos floretes de brócoli, pero non nos brotes de brócoli. A indución de QR en células cultivadas de hepatoma de rato Hepa lclc7 aumentou en paralelo a formación de sulforafano.

O prequecemento de floretes e brotes de brócoli a 60 °C aumentou significativamente a formación de sulforafano (SF) catalizada pola mirosinase nos extractos de tecido vexetal despois da trituración. Isto estivo asociado a diminucións na formación de sulforafano nitrilo (SF Nitrilo) e na actividade da proteína epitioespecificadora (ESP).
Palabras clave: Brócolis, Brassica oleracea, Cruciferae, Cáncer, Anticarcinógeno, Sulforaphane, Sulforaphane nitrilo, Proteína epitioespecífica, Quinone reductasa
En conclusión, o sulforafano é un fitoquímico que se atopa no brócoli e noutras verduras crucíferas. Unha cantidade incontrolada de oxidantes causada por factores internos e externos pode causar estrés oxidativo no corpo humano, o que finalmente pode provocar unha variedade de problemas de saúde. O sulforafano pode activar a produción de Nrf2, un factor de transcrición que axuda a regular os mecanismos antioxidantes protectores que controlan a resposta da célula aos oxidantes. O alcance da nosa información limítase aos problemas de saúde da columna vertebral e quiroprácticos. Para discutir o tema, non dubide en preguntar ao Dr. Jiménez ou en contacto connosco en�915-850-0900 .
Comisariado polo Dr. Alex Jiménez
Referencia de: Sciencedirect.com

Discusión de tema adicional: "Dor de espalda aguda
Dor nas costasÉ unha das causas máis frecuentes de discapacidade e días perdidos no traballo en todo o mundo. A dor nas costas atribúese á segunda razón máis común para as visitas ao médico, só superada en número por infeccións respiratorias superiores. Aproximadamente o 80 por cento da poboación experimentará dor nas costas polo menos unha vez ao longo da súa vida. A columna vertebral é unha estrutura complexa composta por ósos, articulacións, ligamentos e músculos, entre outros tecidos brandos. Debido a isto, lesións e / ou condicións agravadas, comodiscos herniados, pode levar a síntomas de dor nas costas. As lesións deportivas ou as lesións por accidentes automovilísticos adoitan ser a causa máis frecuente de dor nas costas, con todo, ás veces o movemento máis sinxelo pode ter resultados dolorosos. Afortunadamente, as opcións de tratamento alternativas, como o coidado quiropráctico, poden axudar a aliviar a dor nas costas mediante o uso de axustes espiñentos e manipulacións manuais, mellorando o alivio da dor.

EXTRA EXTRA | TEMPO IMPORTANTE: Recomendado El Paso, TX Chiropractor
***
Ámbito de práctica profesional *
A información aquí contenida en "Que é Sulforaphane?" non pretende substituír unha relación individual cun profesional da saúde cualificado ou un médico licenciado e non é un consello médico. Animámoslle a que tome decisións sobre a saúde baseándose na súa investigación e colaboración cun profesional sanitario cualificado.
Información do blog e debates de alcance
O noso ámbito de información limítase a quiropráctica, músculo-esqueléticos, medicamentos físicos, benestar, contribuíndo etiolóxico trastornos viscerosomáticos dentro de presentacións clínicas, dinámica clínica do reflexo somatovisceral asociado, complexos de subluxación, problemas de saúde sensibles e/ou artigos, temas e discusións de medicina funcional.
Proporcionamos e presentamos colaboración clínica con especialistas de diversas disciplinas. Cada especialista réxese polo seu ámbito profesional e a súa xurisdición de licenza. Usamos protocolos funcionais de saúde e benestar para tratar e apoiar a atención das lesións ou trastornos do sistema músculo-esquelético.
Os nosos vídeos, publicacións, temas, temas e coñecementos abarcan asuntos clínicos, cuestións e temas relacionados co noso ámbito de práctica clínica e apoian directa ou indirectamente o noso ámbito de práctica.*
A nosa oficina intentou razoablemente proporcionar citas de apoio e identificou o estudo ou estudos de investigación relevantes que apoian as nosas publicacións. Proporcionamos copias dos estudos de investigación de apoio dispoñibles para os consellos reguladores e o público logo de solicitude.
Entendemos que cubrimos asuntos que requiren unha explicación adicional de como pode axudar nun determinado plan de atención ou protocolo de tratamento; polo tanto, para debater máis sobre o tema anterior, non dubide en preguntar Dr. Alex Jiménez, DC, ou póñase en contacto connosco 915-850-0900.
Estamos aquí para axudarche a ti e á túa familia.
Bendicións
Dr. Alex Jiménez ANUNCIO, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licenciado como Doutor en Quiropráctica (DC) en Texas & Novo México*
Número de licenza de Texas DC TX5807, New Mexico DC Número de licenza NM-DC2182
Licenciada como enfermeira rexistrada (RN*) in Florida
Licenza Florida Licenza RN # RN9617241 (Nº de control 3558029)
Estado compacto: Licenza multiestatal: Autorizado para Practicar en Estados 40*
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
A miña tarxeta de visita dixital






